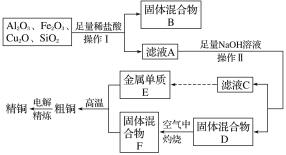
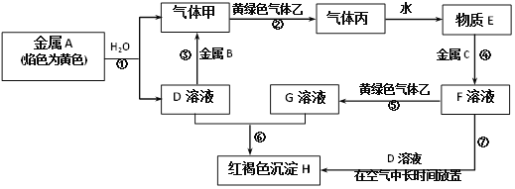
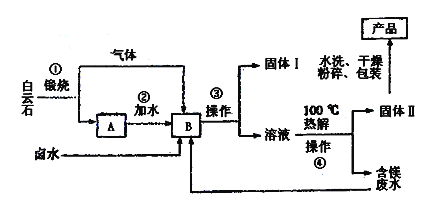
题目内容
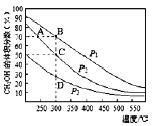
【题目】等体积、浓度均为0.2mol·L-1的三种溶液:①HA溶液、②HB溶液、③NaHCO3溶液,已知将①②分别与③混合,实验测得所产生的CO2气体体积(V)随时间(t)的变化如图所示。下列说法不正确的是
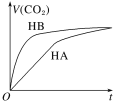
A. 酸性:HB>HA>H2CO3
B. 恰好反应时,所得两溶液中:c(A-)>c(B-)
C. 上述三种溶液中由水电离出的c(OH-)的相对大小:③>①>②
D. HA溶液和NaHCO3溶液恰好反应,所得的溶液中:c(A-)+c(HA)=0.1mol·L-1
【答案】B
【解析】
A.由题图可知,HB溶液与NaHCO3溶液反应的速率较快,说明HB溶液中氢离子浓度较大,所以酸性:HB>HA>H2CO3,故A正确;
B.反应结束后所得两溶液分别为NaA溶液、NaB溶液,根据“越弱越水解”,则c(B-)>c(A-),故B错误;
CNaHCO3水解促进水的电离,酸的酸性越强,对水的电离的抑制程度越大,所以HB对水的电离的抑制程度最大,三种溶液中由水电离出的c(OH-)的相对大小:NaHCO3溶液>HA溶液>HB溶液,故C正确;
D.根据物料守恒可知,HA溶液和NaHCO3溶液反应所得溶液中c(A-)+c(HA)=0.1 mol·L-1,故D正确;
故答案为B。

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目