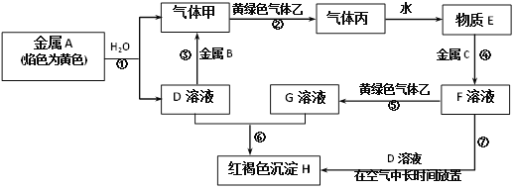
题目内容
【题目】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
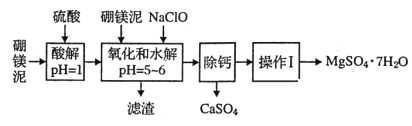
(1)实验中需用1mol/L的硫酸480mL,若用18.4mol/L的浓硫酸来配置,量取浓硫酸时需使用的量筒规格为(_______)。
A 10mL B 20mL C 50mL D 100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-还有一种离子也会被NaClO氧化,该反应的离子方程式为___________________________;滤渣中除含有氢氧化铁、氢氧化铝外还有_________。
(3)在“除钙”前需检验滤液中Fe3+是否被除尽,简述检验方法_____________________。
(4)已知硫酸镁、硫酸钙的溶解度如下表
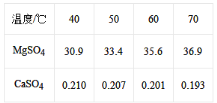
“除钙”是将;硫酸镁和硫酸钙混合溶液中的硫酸钙除去根据上表数据,采取的操作是_______________、趁热过滤、_________、____________,便得到比较纯净的硫酸镁。
(5)实验中提供的硼镁泥共100g,得到的MgSO4·7H2O为172.2g,则MgSO4·7H2O的产率为__________________。
【答案】C 2Fe2++ClO-+2H+=2Fe3+-+Cl-+H2O SiO2 MnO2 取少许滤液于试管中,加入硫氰化钾溶液,若溶液不变红,说明Fe3+已除尽 蒸发浓缩 洗涤 干燥 70﹪
【解析】
由流程图可知,加入硫酸溶液调节溶液pH为1,MgO、CaO、MnO、Fe2O3、FeO、Al2O3金属氧化物都反应溶解,二氧化硅不反应溶解,再加入次氯酸钠溶液,溶液中Mn2+转化为MnO2沉淀,Fe2+被氧化为Fe3+,调节溶液pH为5—6,溶液中Fe3+和Al3+转化为氢氧化铁、氢氧化铝沉淀,过滤,滤渣中含有二氧化锰、二氧化硅、氢氧化铁和氢氧化铝,滤液中含有钙离子和镁离子,由图可知CaSO4的溶解度随温度的变化不大,而MgSO4在温度较高时溶解度大,蒸发浓缩、趁热过滤利于分离硫酸钙和硫酸镁,MgSO4溶液经蒸发、浓缩、结晶、过滤、干燥可得到晶体。
(1)实验中需用1mol/L的硫酸480mL应用500ml容量瓶配制,由稀释定律可得:1mol/L×0.5L=18.4mol/L×VL,V=0.027L=27ml,量取27ml浓硫酸时需使用的量筒规格为50ml,故答案为:C;
(2)溶液中含有Fe2+,具有还原性,可与NaClO发生氧化还原反应,反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;过滤,滤渣中含有二氧化锰、二氧化硅、氢氧化铁和氢氧化铝,滤液中含有钙离子和镁离子,故答案为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;SiO2、MnO2;
(3)检验滤液中Fe3+是否被除尽的操作是取少许滤液于试管中,加入硫氰化钾溶液,若溶液不变红,说明Fe3+已除尽,故答案为:取少许滤液于试管中,加入硫氰化钾溶液,若溶液不变红,说明Fe3+已除尽;
(4)由图可知CaSO4的溶解度随温度的变化不大,而MgSO4在温度较高时溶解度大,蒸发浓缩、趁热过滤利于分离硫酸钙和硫酸镁,MgSO4溶液经蒸发、浓缩、结晶、过滤、干燥可得到晶体,故答案为:蒸发浓缩;洗涤;干燥;
(5)100g硼镁泥中含有氧化镁的质量为100g×40%=40g,氧化镁的物质的量为1mol,则生成MgSO4·7H2O的质量为1mol×246g/mol=246g,则MgSO4·7H2O的产率为172.2g/246g×100%=70%,故答案为:70%。