题目内容
【题目】根据所学知识完成题目:
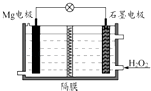
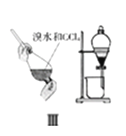
(1)某课外活动小组同学用图1装置进行实验,试回答下列问题:
①若开始时开关K与a连接,则铁发生电化学腐蚀中的腐蚀.请写出正极反应式: .
②若开始时开关K与b连接时,两极均有气体产生,则N端是电源的极(填正或负),则总反应的离子方程式为 .
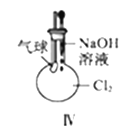
(2)该小组同学设想,用如图2所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠. ①制得的氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)导出.通过阴离子交换膜的离子数(填“>”、“<”或“=”)通过阳离子交换膜的离子数.
②通电开始后,阴极附近溶液pH会增大,请简述原因: .
【答案】
(1)吸氧;O2+4e﹣+2H2O=4OH﹣;负;2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑
2OH﹣+H2↑+Cl2↑
(2)D;<;H+在阴极放电,水的电离平衡正向移动,溶液中OH﹣浓度增大,pH增大(合理即可)
【解析】解:(1)①开关K与a连接,为原电池,NaCl溶液为中性,发生吸氧腐蚀,正极上氧气得电子发生还原反应,电极反应式为O2+4e﹣+2H2O=4OH﹣ , 所以答案是:吸氧;O2+4e﹣+2H2O=4OH﹣;②K与b连接,为电解池,若开始时开关K与b连接时,两极均有气体产生,则Fe作阴极,石墨作阳极,氯离子、氢离子放电,则N为电源负极,电解的总离子反应为2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑,所以答案是:2Cl﹣+2H2O
2OH﹣+H2↑+Cl2↑,所以答案是:2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑;(2)①阴极上氢离子放电,则NaOH在阴极生成,由图可知,D在阴极附近,制得的氢氧化钠溶液从D出口导出;阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数,所以答案是:D;<;②水电离出的氢离子在阴极放电,而氢氧根离子不放电,促进水的电离,导致溶液中氢氧根离子浓度增大,溶液的pH增大, 所以答案是:H+在阴极放电,水的电离平衡正向移动,溶液中OH﹣浓度增大,pH增大(合理即可).
2OH﹣+H2↑+Cl2↑;(2)①阴极上氢离子放电,则NaOH在阴极生成,由图可知,D在阴极附近,制得的氢氧化钠溶液从D出口导出;阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数,所以答案是:D;<;②水电离出的氢离子在阴极放电,而氢氧根离子不放电,促进水的电离,导致溶液中氢氧根离子浓度增大,溶液的pH增大, 所以答案是:H+在阴极放电,水的电离平衡正向移动,溶液中OH﹣浓度增大,pH增大(合理即可).

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】工业上制备H2的一种重要方法是:CO(g)+H2O(g)CO2 (g)+H2(g)△H=QkJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定容积的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如表:已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
时间/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c4 |
4 | c1 | c2 | c3 | c4 |

(1)Q0(填“>”、“=”或“<”).
(2)若在850℃时向反应容器中充人H2O(g),K值(填“增大”、“减小”或“不变”).
(3)上表中 c2为mol/L,CO(g)的转化率为 .