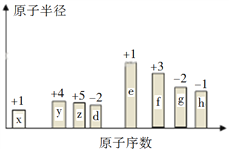
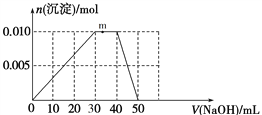
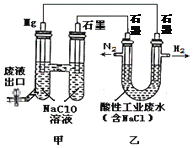
题目内容
【题目】工业上制备H2的一种重要方法是:CO(g)+H2O(g)CO2 (g)+H2(g)△H=QkJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定容积的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如表:已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
时间/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c4 |
4 | c1 | c2 | c3 | c4 |

(1)Q0(填“>”、“=”或“<”).
(2)若在850℃时向反应容器中充人H2O(g),K值(填“增大”、“减小”或“不变”).
(3)上表中 c2为mol/L,CO(g)的转化率为 .
【答案】
(1)<
(2)不变
(3)0.18;60%
【解析】解:(1)由图可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故△H<0,所以答案是:<;(2)在850℃时向反应容器中充入H2O(g),平衡正向移动,但K值不变;所以答案是:不变;(3)CO+H2O(g)CO2 +H2 , 起始(mol/L)0.200 0.300 00
反应(mol/L) aa a a
平衡(mol/L)0.200﹣a 0.300﹣a a a
K= ![]() =1,解得a=0.12,
=1,解得a=0.12,
所以c2=0.300﹣a=0.18,CO(g)的转化率为 ![]() ×100%=
×100%= ![]() ×100%=60%,所以答案是:0.18;60%.
×100%=60%,所以答案是:0.18;60%.
【考点精析】关于本题考查的等效平衡,需要了解在条件不变时,可逆反应不论采取何种途径,即由正反应开始或由逆反应开始,最后所处的平衡状态是相同;一次投料或分步投料,最后所处平衡状态是相同的,某一可逆反应的平衡状态只与反应条件(物质的量浓度、温度、压强或体积)有关,而与反应途径(正向或逆向)无关才能得出正确答案.

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案