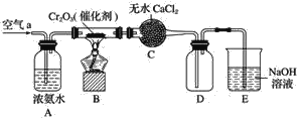
题目内容
【题目】已知25℃时,H2SO3的电离常数Ka1=1.23![]() 10-2,Ka2=5.6
10-2,Ka2=5.6![]() 10-8,HClO的电离常数Ka=2.98
10-8,HClO的电离常数Ka=2.98![]() 10-8,下列说法错误的是
10-8,下列说法错误的是
A.常温下,相同浓度的H2SO3 比HClO酸性强
B.常温下,将NaHSO3溶液滴入到NaClO溶液中不发生化学反应
C.常温下,NaHSO3溶液中HSO3-的电离程度大于其水解程度,NaHSO3溶液呈酸性
D.将pH=5的HClO溶液加水稀释到pH=6时,溶液中部分离子浓度会升高
【答案】B
【解析】
A. 常温下,已知Ka1>Ka,相同浓度的H2SO3比HClO电离程度大,则酸性强,A正确;
B. 常温下,将NaHSO3溶液滴入到NaClO溶液中发生氧化还原反应,生成硫酸钠和盐酸,B错误;
C. 常温下,已知Ka2>Kw/Ka1,NaHSO3溶液中HSO3-的电离程度大于其水解程度,则HSO3-电离产生的氢离子浓度大于其水解产生的氢氧根离子浓度,导致溶液中c(H+)>c(OH-),则NaHSO3溶液呈酸性,C正确;
D. 将pH=5的HClO溶液加水稀释到pH=6时,c(H+)减小,水的离子积不变,则c(OH-)增大,溶液中部分离子浓度会升高,D正确;
答案为D。

【题目】已知:①1mol晶体硅中含有2molSi—Si键。
②Si(s)+O2(g)===SiO2(g) ΔH,其反应过程与能量变化如图所示。
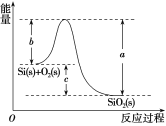
③
化学键 | Si—O | O=O | Si—Si |
断开1 mol共价键所需能量/kJ | 460 | 500 | 176 |
下列说法中正确的是( )
A.晶体硅光伏发电是将化学能转化为电能B.二氧化硅稳定性小于硅的稳定性
C.ΔH=-988kJ·mol-1D.ΔH=(a-c)kJ·mol-1
【题目】下表中列出了25 ℃、101 kPa时一些物质的燃烧热数据:
物质 | CH4(g) | CH3OCH3(g) | H2(g) | HC≡CH(g) |
燃烧热/(kJ·mol-1) | 890.3 | 1 453.0 | 285.8 | 1 299.6 |
已知:①1 mol液态水变为气态水要吸收44.0 kJ的热量;
②键能:C—H键 413.4 kJ·mol-1、H—H键 436.0 kJ·mol-1。
下列叙述错误的是
A. CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1 453.0 kJ·mol-1
B. C≡C键的键能为786.0 kJ·mol-1
C. 2CH4(g)+O2(g)=CH3OCH3(g)+H2O(g) ΔH=-283.6 kJ·mol-1
D. H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1