题目内容
能在透明溶液中大量共存的一组离子是
| A.Na+、NH4+、OH-、HCO3- | B.Mg2+、Ag+、NO3-、SiO32- |
| C.K +、Cu2+、Cl-、SO42- | D.H+、Fe3+、I-、ClO- |
C
解析试题分析:铵根离子与氢氧根离子容易反应,生成一水合氨或氨气和水,氢氧根离子与碳酸氢根离子容易反应,生成二氧化碳气体和水,故A选项错误;镁离子与硅酸根离子容易反应,生成硅酸镁沉淀或氢氧化镁沉淀和硅酸沉淀,银离子与硅酸根离子容易反应,生成氢氧化银沉淀和硅酸沉淀,故B选项错误;K +、Cu2+、Cl-、SO42-之间不能反应,故C选项正确;氢离子与次氯酸根离子容易反应,生成次氯酸,铁离子与碘离子容易反应,生成亚铁离子和单质碘,铁离子与次氯酸根离子容易反应,生成氢氧化铁沉淀和次氯酸,故D选项错误。
考点:考查离子共存,主要涉及离子之间反应生成难溶物、难电离物和易挥发物、氧化还原反应、双水解反应、复水解反应等。

练习册系列答案
相关题目
下表中有关离子方程式的评价合理的是 ( )
| 选项 | 化学反应及离子方程式 | 评价 |
| A | AlCl3溶液中加入过量氨水: Al3++3NH3·H2O=Al(OH)3¯+3NH4+ | 错误,铝元素的产物应该是AlO2﹣(或[Al(OH)4﹣]) |
| B | 过量氯气通入溴化亚铁溶液中: 3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2 | 正确 |
| C | 用氨水吸收过量二氧化硫: 2NH3·H2O+SO2=2NH4++SO32-十H2O | 正确 |
| D | 氯化铵溶于水: NH4+ + 2H2O = H3O+ + NH3·H2O | 错误,氯化铵溶解于水是物理变化,不能写离子方程式 |
常温下,下列各组离子在特定溶液中一定能大量共存的是
| A.pH=12的澄清的溶液中:K+、Na+、MnO4-、SO42- |
| B.c(Al3+) ="0.1" mol·L-1的溶液中:Na+、Cl-、HCO3-、SO42- |
| C.甲基橙呈红色的溶液中:NH4+、Ba2+、AlO2-、Cl- |
| D.加入少量铝粉后能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42- |
下列反应的离子方程式正确的是
| A.向稀氨水中加入稀盐酸 OH- + H+ =H2O |
| B.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
| C.碳酸钙溶于醋酸中 CaCO3 + 2H+ =Ca2+ + H2O + CO2↑ |
| D.碳酸氢钙溶液跟稀硝酸反应 HCO3-+ H+ = H2O + CO2↑ |
下列各组离子能大量共存的是
| A.NaClO水溶液中:Fe2+、Cl-、Ca2+、H+ |
| B.加入KSCN显红色的溶液:K+、Na+、I-、S2- |
| C.无色酸性溶液中:K+、CH3COO-、HCO3-、MnO4- |
| D.pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ |
下列离子方程式正确的是
| A.氯化铁溶液中加入铜粉:Fe3++Cu=Fe2++Cu2+ |
| B.等体积、等物质的量浓度的NH4HCO3和Ca(OH)2溶液混合:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| C.水玻璃中通入过量CO2:SiO32-+2CO2+2H2O=H2SiO3(胶体)+2HCO3- |
| D.少量S02通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
下列反应的离子方程式正确的是
A.将氯气溶于水制备次氯酸:Cl2+H2O 2H++Cl-+ClO- 2H++Cl-+ClO- |
| B.少量CO2通入苯酚钠溶液中:2C6H5O-+CO2+H2O=2C6H5OH+CO32- |
| C.Na2O2与H2O混合:2Na2O2+2H2O=4Na++4OH-+O2↑ |
D.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH- NH3↑+H2O NH3↑+H2O |
若溶液中由水电离产生的C (OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是:
| A.Al3+ Na+NO3- Cl- | B.K+ Na+Cl- NO3- |
| C.K+ Na+ Cl-AlO2- | D.K+ NH4+ SO42-NO3- |
(10分)某科研小组设计出利用工业废酸(l0%)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,如下图所示。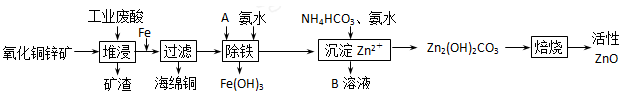
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。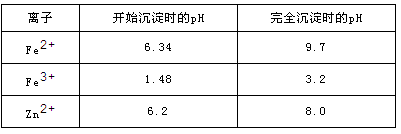
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,则相同温度下:Ksp(CuS)______Ksp(ZnS)(选填“>”“<”或“=”)。
(2)物质A可使用下列物质中的 。
| A.KMnO4 | B.O2 | C.H2O2 | D.Cl2 |
(4)物质B可直接用作氮肥,则B的化学式是________。
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式__________。