题目内容
下列离子方程式正确的是
| A.氯化铁溶液中加入铜粉:Fe3++Cu=Fe2++Cu2+ |
| B.等体积、等物质的量浓度的NH4HCO3和Ca(OH)2溶液混合:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| C.水玻璃中通入过量CO2:SiO32-+2CO2+2H2O=H2SiO3(胶体)+2HCO3- |
| D.少量S02通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
C
解析试题分析:A项电荷不守恒,A错;B项二者的物质的量相等,还存在NH4+与OH-的反应,B错;碳酸的酸性强于硅酸,C正确;HClO有强氧化性,可将CaSO3氧化为CaSO4,D错。
考点:离子方程式正误的判断。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
常温下,下列各组离子在指定溶液中能大量共存的是
| A.H2S溶液中: Br-、Na+ 、SO42-、Hg2+ |
| B.c(H+)=l×l0-13mol/L的溶液中:K+ 、Cl-、SO42-、 C6H5O- |
| C.与铝反应产生大量氢气的溶液中: NO3-、I- 、Al3+、Na+ |
| D.含有0.1mol/L Fe3+的溶液中: CO32-、NH4+、 NO3-、 Na+ |
在水溶液中能大量共存的一组离子是
| A.Al3+、Na+、HCO3-、SO42- | B.H+、Fe2+、ClO-、Cl- |
| C.Mg2+、K+、SO42-、NO3- | D.NH4+、Ag+、OH-、Br- |
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。其中Y所处的周期序数与族序数相等。下列说法正确的是
| | | X | |
| Y | Z | | W |
A.原子半径:Y<Z<W
B.气态氢化物的稳定性:X>Z
C.最高价氧化物对应水化物的酸性:Z>W
D.W的最高价氧化物与水反应形成的化合物是离子化合物
能在透明溶液中大量共存的一组离子是
| A.Na+、NH4+、OH-、HCO3- | B.Mg2+、Ag+、NO3-、SiO32- |
| C.K +、Cu2+、Cl-、SO42- | D.H+、Fe3+、I-、ClO- |
配合物在许多方面有着广泛的应用。下列叙述不正确的是
| A.CuSO4溶液呈天蓝色是因为含有[Cu(H2O)4]2+ |
| B.魔术表演中常用一种含硫氰化铁配离子的溶液来代替血液 |
| C.[Ag(NH3)2]+是化学镀银的有效成分 |
| D.除去硝酸银溶液中的Ag+,可向其中逐滴加入氨水 |
下列物质中,属于非电解质的是
| A.盐酸 | B.NaCl | C.蔗糖 | D.铜 |
下列文字表述与反应方程式对应且正确的是
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素: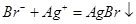 |
B.用醋酸除去水垢: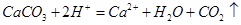 |
C.苯酚钠溶液中通入少量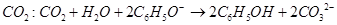 |
D.实验室用液溴和苯在催化剂作用下制溴苯: |
(14分)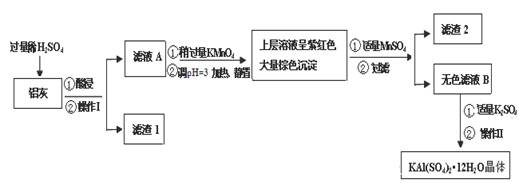
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是 ,操作Ⅱ是蒸发浓缩、 、过滤、 干燥。
(3)检验滤液A中是否存在Fe2+的方法是 (只用一种试剂)
(4)在滤液A中加入高锰酸钾的目的是 ,发生反应的离子方程式为(该条件下Fe2+转化为Fe3+,MnO4- 转化为Mn2+) 。
已知:生成氢氧化物沉淀的pH如下表所示
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释调pH=3的目的 。
(5)己知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为: 。滤渣2含有的物质是 。
(6)以Al和NiO(OH)为电极,KOH溶液为电解液可组成新型、高效电池,充放电过程中,发生Ni(OH)2与NiO(OH)之间的转化,写出放电时电池反应的化学方程式 。