题目内容
下表中有关离子方程式的评价合理的是 ( )
| 选项 | 化学反应及离子方程式 | 评价 |
| A | AlCl3溶液中加入过量氨水: Al3++3NH3·H2O=Al(OH)3¯+3NH4+ | 错误,铝元素的产物应该是AlO2﹣(或[Al(OH)4﹣]) |
| B | 过量氯气通入溴化亚铁溶液中: 3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2 | 正确 |
| C | 用氨水吸收过量二氧化硫: 2NH3·H2O+SO2=2NH4++SO32-十H2O | 正确 |
| D | 氯化铵溶于水: NH4+ + 2H2O = H3O+ + NH3·H2O | 错误,氯化铵溶解于水是物理变化,不能写离子方程式 |
B
解析试题分析:A.评价错,氢氧化铝之溶于强碱,不溶于弱碱;C.用氨水吸收过量的二氧化硫,生成亚硫酸氢钠;D.溶解过程是一个复杂的物理化学变化,铵根水解是化学变化,可以写离子方程式。
考点:考查物质变化和离子方程式书写。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水,向一定量的W的最高价氧化物对应的水化物溶液中逐滴加人XZ3溶液,生成的沉淀X(OH)3的质量随XZ3溶液加人量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是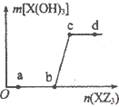
| A.d点对应的溶液中:K+、NH4+、CO32-、I- |
| B.c点对应的溶液中:Ag+、Ca2+、NO3-、Na+ |
| C.b点对应的溶液中:Na+、S2-、SO42-、Cl- |
| D.a点对应的溶液中:Na+、K+、S042-、HCO3- |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.1.0 mol·L-1的CaCl2溶液:Na+、K+、Cl-、CO32- |
| B.1.0 mol·L-1的HNO3溶液:K+、[Ag(NH3)2]+、Cl-、SO42- |
| C.1.0 mol·L-1的KI溶液: Na+、Fe3+、Cl-、SO42- |
| D.澄清透明的溶液:Cu2+、SO42-、Mg2+、Cl- |
下列离子方程式表达正确的是
| A.硫化亚铁溶于足量的稀硝酸中:FeS + 2H+ = Fe2+ + H2S↑ |
| B.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:H++SO42—+Ba2++OH—=BaSO4↓+ H2O |
| C.向溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| D.等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合: |
下列离子方程式中正确的是 ( )
A.用石墨作电极电解饱和NaCl溶液:2C1-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
B.向明矾溶液中逐滴加入Ba( OH)2溶液至Al3+刚好沉淀完全:Al3+ +SO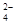 + Ba2+ +3OH- + Ba2+ +3OH- |
| C.过量氯气通人溴化亚铁溶液中2Cl2 +2Fe2+ +2Br- |
| D.向氯化铝溶液通入过量的氨气:Al3+ +4OH- |
常温下,下列各组离子在指定溶液中能大量共存的是
| A.H2S溶液中: Br-、Na+ 、SO42-、Hg2+ |
| B.c(H+)=l×l0-13mol/L的溶液中:K+ 、Cl-、SO42-、 C6H5O- |
| C.与铝反应产生大量氢气的溶液中: NO3-、I- 、Al3+、Na+ |
| D.含有0.1mol/L Fe3+的溶液中: CO32-、NH4+、 NO3-、 Na+ |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- |
| B.c(H+)/ c (OH—)=10-10的溶液:K+、Ba2+、NO3-、Cl- |
| C.pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- |
| D.c(ClO-)=1.0 mol·L-1的溶液:Na+、SO32-、S2-、SO42- |
能在透明溶液中大量共存的一组离子是
| A.Na+、NH4+、OH-、HCO3- | B.Mg2+、Ag+、NO3-、SiO32- |
| C.K +、Cu2+、Cl-、SO42- | D.H+、Fe3+、I-、ClO- |
下列离子组能大量共存的是
| A.Ba2+、Cl-、SO42-、K+ | B.Mg2+、SO42-、Na+、Cl- |
| C.H+、CO32-、Al3+、Cl- | D.K+、Fe2+、NO3-、H+ |