题目内容
18.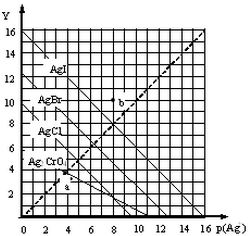 卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )
卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )| A. | 该温度下Ag2CrO4的Ksp约为1×10-22 | |
| B. | a点可表示AgCl的饱和溶液 | |
| C. | b点c(Ag+)=c(I-) | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
分析 A、结合图象,依据Ksp(Ag2CrO4)=c2(Ag+)×c(CrO42-)计算即可;
B、依据a点计算出AgCl的Qc与Ksp(AgCl)比较,若Qc>Ksp(AgCl),则此时溶液为饱和溶液,据此解答即可;
C、依据图象分别得出此时c(Ag+)和c(I-)即可判断;
D、依据图象得出此温度下,AgCl的溶解度大于AgBr的溶解度,据此判断浓度即可.
解答 解:A、依据图象得出此温度下,当Y=0,即Y=-lgc(CrO42-)=0,c(CrO42-)=1时,p(Ag+)═-lgc(Ag+)=12,故Ksp(Ag2CrO4)=c2(Ag+)×c(CrO42-)=(1×10-12)2×1=10-24,故A错误;
B、由图象得出此温度下,饱和AgCl溶液的Ksp(AgCl)=10-10,a点c(Ag+)=10-4:c(Cl-)=10-4,故AgCl的Qc=c(Cl-)×c(Ag+)=10-8>10-10,此点为氯化银的饱和溶液,故B正确;
C、由图象得出b点c(Ag+)=10-8,c(I-)=10-10,两者不相同,故C错误;
D、由于此温度下,AgCl的溶解度大于AgBr的溶解度,故溶液中c(Cl-)>c(Br-),故D错误,
故选B.
点评 本题主要考查的是难溶电解质的溶解平衡图象以及分析图象的能力,充分理解图象并从图象中得出解题所需要的信息是关键,锻炼了同学们识图、信息整合的能力.

练习册系列答案
相关题目
8.下列反应中,Q2>Q1的是( )
| A. | H2(g)+F2(g)=2HF(g)△H=-Q1 kJ•mol-1 H2(g)+Cl2(g)=2HCl(g)△H=-Q2 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)=2H2O(l)△H=-Q1 kJ•mol-1 2H2(g)+O2(g)=2H2O(g)△H=-Q2 kJ•mol-1 | |
| C. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-Q1 kJ•mol-1 NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-Q2 kJ•mol-1 | |
| D. | S(s)+O2(g)=SO2(g)△H=-Q1 kJ•mol-1 S(g)+O2(g)=SO2(g)△H=-Q2 kJ•mol-1 |
9.钠硫电池属于温绿色二次电流,用液态钠、硫和多硫化钠作电极,以能传导钠离子的固体氧化铝作电解质.电池反应为:2Na+xS$?_{充电}^{放电}$Na2Sx.下列有关说法正确的是( )
| A. | 放电时,Na+向负极移动 | |
| B. | 放电时,正极上发生的反应为xS+2Na++2e-=Na2Sx | |
| C. | 充电时,阳极上发生的反应为2Na-2e-=2Na+ | |
| D. | 放电时,每有0.4mol电子转移,则有9.2gNa和6.4g硫参加反应 |
3.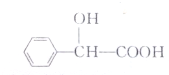 某有机物的结构如下所示,有关该物质的说法错误的是( )
某有机物的结构如下所示,有关该物质的说法错误的是( )
 某有机物的结构如下所示,有关该物质的说法错误的是( )
某有机物的结构如下所示,有关该物质的说法错误的是( )| A. | 该物质的分子式为C8H8O3 | |
| B. | 该物质分子中的8个碳原子都在同一个平面上 | |
| C. | 该物质既可以发生酯化反应又可以发生缩聚反应 | |
| D. | 1mol该物质可以与2mol金属Na反应 |
1.取一定质量的均匀固体混合物Cu、CuO和Cu2O,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少3.20g,另一份中加入500mL稀硝酸(其还原产物为NO),固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )
| A. | 2.4mol/L | B. | 1.4mol/L | C. | 1.2mol/L | D. | 0.7mol/L |
2.在一定条件下,对于密闭容器中进行的反应:X(g)+3Y(g)?2Z(g),下列说法能充分说明该反应已达到化学平衡状态的是( )
| A. | X、Y、Z的浓度相等 | B. | X、Y、Z在容器中共存 | ||
| C. | 正、逆反应速率都等于零 | D. | X、Y、Z的浓度均不再改变 |

 一名同学把4.48L(一折算成标准状况下)某有机物蒸汽在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓硫酸的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
一名同学把4.48L(一折算成标准状况下)某有机物蒸汽在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓硫酸的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示: