题目内容
2.在一定条件下,对于密闭容器中进行的反应:X(g)+3Y(g)?2Z(g),下列说法能充分说明该反应已达到化学平衡状态的是( )| A. | X、Y、Z的浓度相等 | B. | X、Y、Z在容器中共存 | ||
| C. | 正、逆反应速率都等于零 | D. | X、Y、Z的浓度均不再改变 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、X、Y、Z的浓度相等而不是不变,所以不一定达平衡状态,故A错误;
B、可逆反应就是反应物和生成物共存的体系,故B错误;
C、化学平衡状态是动态平衡,平衡时速率不等于0,故C错误;
D、X、Y、Z的浓度均不再改变,说明反应达平衡状态,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
18.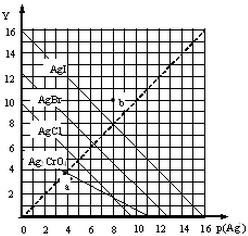 卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )
卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )
 卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )
卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )| A. | 该温度下Ag2CrO4的Ksp约为1×10-22 | |
| B. | a点可表示AgCl的饱和溶液 | |
| C. | b点c(Ag+)=c(I-) | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
13.有关下列反应的说法中,正确的是( )
| A. | 锌粒投入Cu(NO3)2溶液中,反应后固体物质增重 | |
| B. | 22.4L Cl2通入足量NaOH溶液,反应时转移的电子数为2NA | |
| C. | lmol Na在空气中加热燃烧,反应时转移的电子数为NA | |
| D. | 等物质的量的MgCl2、Ba(OH)2和 HCl溶液混合:Mg2++2OH-=Mg(OH)2↓ |
7.已知短周期元素的离子aA2+、bB+、cC2?、dD?都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径A>B>C>D | |
| B. | 原子序数d>c>b>a | |
| C. | 离子半径C>D>B>A | |
| D. | 单质的还原性A>B离子的还原性C2?>D? |
11.用0.01mol/L NaOH溶液完全中和pH=3的下列溶液各100mL.需NaOH溶液体积最大的是( )
| A. | 盐酸 | B. | 硝酸 | C. | 醋酸 | D. | 高氯酸 |
12.一定能在下列溶液中大量共存的离子组是( )
| A. | 水电离产生的H+浓度为1×10-12mol•L-1的溶液:NH4+、Na+、C1-、HCO3- | |
| B. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| C. | 能使pH试纸变蓝色的溶液:Na+、S2-、CO32-、AlO2- | |
| D. | 澄清透明的无色溶液:ClO-、MnO4-、A13+、SO42- |
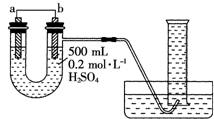 现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:
现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题: