题目内容
【题目】回收利用炼铜工业产生的排放物,既能节约资源,又能保护环境.
(1)用足量氨水吸收尾气中的SO2后,再加入硫酸,可获得SO2和(NH4)2SO4两种产品.相关反应的化学方程式为________、________.
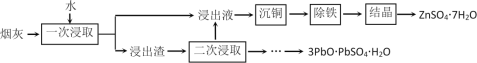
(2)烟灰中金属元素以硫酸盐和氧化物形态存在,其中锌、铅的含量最大,其次为铜、铁等.烟灰的回收利用工艺如下:
①“沉铜”可得到单质铜,该步骤应加入的试剂是________.
② “一次浸取”铜浸出率较低,原因是烟灰中部分铜元素以________(填化学式)残留在浸出渣中,“二次浸取”应选择_________(填化学式)作浸取剂.
(3)从贵金属阳极泥中可提取粗银.电解法精炼粗银时采用AgNO3和HNO3的混合液作电解液,阴极的主要电极反应式为________.阴极还有少量副反应发生,产生的气体遇空气迅速变为红棕色,该副反应的电极反应式为________.
【答案】(1)SO2+2NH3·H2O=(NH4)2SO3+H2O(2分) (生成物写NH4HSO3也得分)
(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O (2分)
(2)①锌粉(或铁粉) (3分) ② CuO (2分) H2SO4(2分)
(3)Ag++e—=Ag(2分) NO3—+4H++3e—=NO↑+2H2O (3分)
【解析】
试题(1)氨水吸收尾气中的SO2后生成亚硫酸铵,方程式为SO2+2NH3·H2O=(NH4)2SO3+H2O。亚硫酸铵与硫酸反应生成硫酸铵、SO2和水,因此再加入硫酸,可获得SO2,反应的化学方程式为(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O。
(2)①由于最终要获得硫酸锌晶体,因此根据不能引入杂质可判断“沉铜”时应该加入还原剂锌。
② 由于烟灰中部分铜以氧化物氧化铜的形成存在,而氧化铜不溶于水,所以“一次浸取”铜浸出率较低。氧化铜不溶于水,但可溶于稀硫酸中,则“二次浸取”应选择H2SO4作浸取剂。
(3)电解法精炼粗银时采用AgNO3和HNO3的混合液作电解液,阴极是溶液中的银离子放电,则主要电极反应式为Ag++e—=Ag。阴极还有少量副反应发生,产生的气体遇空气迅速变为红棕色,这说明应该是溶液中的硝酸根得到电子转化为NO,NO被氧化为红棕色NO2,因此该副反应的电极反应式为NO3—+4H++3e—=NO↑+2H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案