题目内容
A、B、C、D、E、F、G都是链状有机物,它们的转化关系如下图所示。已知:
(1)Mr(R-Cl)-Mr(ROH)=18.5,Mr(RCH2OH)-Mr(RCHO)=2,Mr表示相对分子质量;
(2) 中的—OH不能被氧化。
中的—OH不能被氧化。

A中只含一种官能团,D的相对分子质量与E相差42,D的核磁共振氢谱图上有3个峰,峰面积之比为1:3:6,且D中不含甲基,请回答下列问题:
(1)A中含有的官能团是?????????????? 。
(2)写出D的分子式?????????????? 。
(3)下列有关A~G的说法正确的是????????? 。
a.每个A分子中含有官能团的数目为4个
b.B中所有官能团均发生反应生成C
c.C生成G只有1种产物
d.G存在顺反异构现象
(4)写出B生成C的化学方程式??????????????????????????????????????????????? 。
(5)芳香族化合物H与G互为同分异构体,1 mol H与足量氢氧化钠溶液反应消耗2 mol NaOH,则H共有????? 种属于芳香族化合物的同分异构体,若H苯环上的一氯代物只有两种,且1 mol H与足量的钠反应产生1.5 mol氢气,写出其中任意一种符合条件的H的结构简式???????????????? 。
(6)E与足量NaOH溶液共热,此反应的化学方程式为???????????????????????????? 。
(1)Cl(或氯原子)(1分)
(2)C7H10O7? (2分)
(3)ac? (2分,回答一个得1分)??
(4)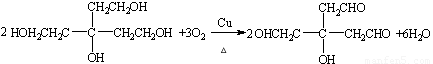 (3分)
(3分)
(5)12种(2分),??? 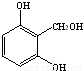 或
或 (2分)
(2分)
(6)
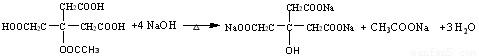 (3分)
(3分)
【解析】
试题分析:(1)C能发生银镜反应,说明B为醇,根据反应条件判断A中有氯原子;(2)根据反应流程可以看出D既可以和酸又可以与醇发生酯化反应,所以D中含有的官能团是为羧基和羟基,根据酯化反应的原理可以退出D的分子式为C7H10O7,(3)根据信息(1)Mr(R-Cl)-Mr(ROH)=18.5,Mr(RCH2OH)-Mr(RCHO)=2,Mr表示相对分子质量;说明A中有74÷18.5=4个氯原子,B中有6÷2=3个最终变为醛基,D的核磁共振氢谱图上有3个峰,且峰面积之比为1:3:6,说明D中含有三种不同的氢原子,即可退出其结构式,逆向推导可以得到A、B、C;结合条件可以出反应方程式;(4)

(5)1molH与足量氢氧化钠溶液反应消耗2molNaOH,说明H含有羟基或者羧基,且H苯环上的一氯代物只有两种,即可写出其结构式。
考点:酯化反应原理、醇和醛的氧化、同分异构体的书写。

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.