题目内容
【题目】按要求填空:
(1)FeO·Cr2O3+NaNO3![]() Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为________,该反应的氧化产物为_____________,该步骤不能使陶瓷容器,用反应式说明:_________。
Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为________,该反应的氧化产物为_____________,该步骤不能使陶瓷容器,用反应式说明:_________。
(2)完成下列反应_____ MnO4—+H2O2+___=Mn2++__+H2O。
(3)Na2CO3溶液中通入足量Cl2,写出其离子反应方程式:_______________。
(4)将0.03mol Fe3O4完全溶解在200ml3. 00mol/L硫酸中,然后加入20.00ml K2Cr2O7溶液,
恰好使Fe2+全部转化为Fe3+,且Cr2O72—中的铬全部转化为Cr3+,则, K2Cr2O7的物质的量浓度是________。
(5)用离子反应方程式表示泡沫灭火器的反应原理:__________________。
【答案】2:7 Na2CrO4和Fe2O3 SiO2+ Na2CO3 ![]() Na2SiO3+ CO2↑
Na2SiO3+ CO2↑ ![]() 、5、6H+、2、5 O2↑、8 CO32—+2 Cl2+H2O=2Cl—+2HClO+ CO2 0.25mol/L Al3++3HCO3—=Al(OH)3↓+3 CO2↑
、5、6H+、2、5 O2↑、8 CO32—+2 Cl2+H2O=2Cl—+2HClO+ CO2 0.25mol/L Al3++3HCO3—=Al(OH)3↓+3 CO2↑
【解析】
(1)1mol FeO·Cr2O3参与反应共失去7mol电子,而1mol NaNO3参与反应得到2mol电子,根据得失电子守恒,可求出二者的化学计量数之比;由价态变化,可确定氧化产物。该步骤不能使陶瓷容器是因为SiO2和Na2CO3在高温下能发生反应;
(2)双氧水中氧元素的化合价从![]() 价升高到0价,失去1个电子,而高锰酸钾中锰元素的化合价从
价升高到0价,失去1个电子,而高锰酸钾中锰元素的化合价从![]() 价降低到
价降低到![]() 价,得到2个电子,根据电子的得失守恒,可得配平后的反应;
价,得到2个电子,根据电子的得失守恒,可得配平后的反应;
(3)Na2CO3溶液中通入足量Cl2,能发生反应生成氯化钠、次氯酸、二氧化碳和水;
(4)0.03mol Fe3O4中FeO为0.03mol,溶于硫酸生成Fe2+,被20.00ml K2Cr2O7溶液全部氧化转化为Fe3+,依据得失电子数目守恒计算K2Cr2O7的物质的量浓度;
(5)氯化铝与碳酸氢钠相发生双水解反应生成氢氧化铝沉淀和二氧化碳气体。
(1)1mol FeO·Cr2O3参与反应共失去7mol电子,而1mol NaNO3参与反应得到2mol电子,根据得失电子守恒,二者的化学计量数比为2:7,氧化产物为Na2CrO4和Fe2O3,该步骤不能使陶瓷容器是因为SiO2和Na2CO3在高温下能发生反应生成硅酸钠和二氧化碳,反应的化学方程式为SiO2+ Na2CO3 ![]() Na2SiO3+ CO2↑,故答案为:2:7; Na2CrO4和Fe2O3;SiO2+ Na2CO3
Na2SiO3+ CO2↑,故答案为:2:7; Na2CrO4和Fe2O3;SiO2+ Na2CO3 ![]() Na2SiO3+ CO2↑;
Na2SiO3+ CO2↑;
(2)双氧水中氧元素的化合价从![]() 价升高到0价,失去1个电子。而高锰酸钾中锰元素的化合价从
价升高到0价,失去1个电子。而高锰酸钾中锰元素的化合价从![]() 价降低到
价降低到![]() 价,得到2个电子,根据电子的得失守恒可知,配平后的反应为2MnO4—+5H2O2+6H+=2Mn2++5 O2↑+8H2O ,故答案为:
价,得到2个电子,根据电子的得失守恒可知,配平后的反应为2MnO4—+5H2O2+6H+=2Mn2++5 O2↑+8H2O ,故答案为:![]() 、5、6H+、2、5 O2↑、8;
、5、6H+、2、5 O2↑、8;
(3)Na2CO3溶液中通入足量Cl2,能发生反应生成氯化钠、次氯酸、二氧化碳和水,反应的离子反应方程式为CO32—+2 Cl2+H2O=2Cl—+2HClO+ CO2,故答案为:CO32—+2Cl2+H2O=2Cl—+2HClO+ CO2;
(4)0.03mol Fe3O4中FeO为0.03mol,溶于硫酸生成Fe2+,被20.00ml K2Cr2O7溶液全部氧化转化为Fe3+,依据得失电子数目守恒可得0.03mol×1=c(K2Cr2O7)×2×0.2L,解得c(K2Cr2O7)=0.25mol/L,答案为:0.25mol/L;
(5)氯化铝与碳酸氢钠相发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为Al3++3HCO3—=Al(OH)3↓+3 CO2↑,故答案为:Al3++3HCO3—=Al(OH)3↓+3 CO2↑。

【题目】(I)![]() 和
和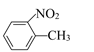 的一些物理性质如下表:
的一些物理性质如下表:
物质 | 熔点 | 沸点 | 密度 | 水溶性 |
| -10℃ | 212℃ | 1.1622g/mL | 不溶于水 |
| 54℃ | 238℃ | 1.1581g/mL | 不溶于水 |
①分离这两种物质混合物可采用的方法是__。(填序号)
A.过滤 B.分液 C.蒸发 D.分馏
②实验需要用到的主要玻璃仪器是___。
(II)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有___、___等。
(2)若用如图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为___、___。
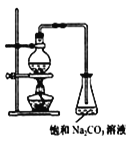
(3)此反应以浓硫酸为催化剂,可能会造成___、__问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)
同一反应时间 | 同一反应温度 | ||||
反应温度/℃ | 转化率(%) | 选择性(%) | 反应时间/h | 转化率(%) | 选择性(%) |
40 | 77.8 | 100 | 2 | 80.2 | 100 |
60 | 92.3 | 100 | 3 | 87.8 | 100 |
80 | 92.6 | 100 | 4 | 92.3 | 100 |
120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
根据表中数据,下列___(填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h
C.60℃,4h D.40℃,3h

