题目内容
【题目】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为:N2O4(g)![]() 2NO2(g)△H=+24.4kJ/mol。
2NO2(g)△H=+24.4kJ/mol。
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是_________________(填写代号)。
a.υ正(N2O4)=2υ逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,则混合气体颜色________(填“变深”、“变浅”或“不变”)判断理由是____________________________________________________________________。
(2)上述反应中,正反应速率υ正=k正·p(N2O4),逆反应速率υ逆=k逆·p2(NO2),其中k正、k逆为速率常数,p(N2O4),p(NO2)为N2O4,NO2的分压,分压=总压×物质的量分数,则Kp为_________(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强100kPa),已知该条件下k正=4.8×l04s-1,当N2O4分解10%时,υ正=___________kPa·s-1。
(3)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为α。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为(用α表示)_______________________。
【答案】bc 变深 正反应吸热,其他条件不变时,升温平衡正向移动 ![]() 3.9×106
3.9×106 ![]()
【解析】
(1)a项,当![]() 时,达到化学平衡,
时,达到化学平衡,![]() 时,说明正、逆反应速率不相等,反应没有达到平衡状态,故不选a项;
时,说明正、逆反应速率不相等,反应没有达到平衡状态,故不选a项;
b项,![]() 为无色,
为无色,![]() 为红棕色,当体系中颜色不变时,各组分的浓度不变,反应达到平衡状态,故选b项;
为红棕色,当体系中颜色不变时,各组分的浓度不变,反应达到平衡状态,故选b项;
c项,密闭容器中,气体总质量不变,由于该反应为非等体积反应,建立平衡过程中气体总物质的量增大,混合气的平均相对分子质量减小,达到平衡时混合气的总物质的量不变,混合气的平均相对分子质量不变能说明反应达到平衡,故选c项;
d项,反应过程中,气体质量和体积均不变,密度始终不变,气体的密度不变不能说明反应达到平衡,故不选d项。
综上所述,本题正确答案为bc。
N2O4(g)2NO2(g)H=+24.4kJ/mol,正反应为吸热反应,其他条件不变,升高温度,平衡正向移动,![]() 增加,颜色加深。
增加,颜色加深。
(2)当反应达到平衡时,υ正=υ逆,则有![]() ,而Kp=
,而Kp=![]() =
=![]() 。
。
当![]() 分解10%时,容器中
分解10%时,容器中![]() 的体积分数变为
的体积分数变为![]() ,则
,则![]() ,
,![]() 。
。
(3)设总压强为![]() 时,
时,![]() 的平衡分解率为β,
的平衡分解率为β,
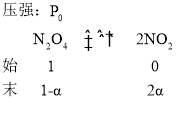 ,
,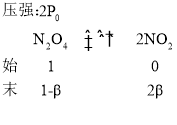
两种情况下,温度不变,则平衡常数不变,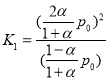 ,
,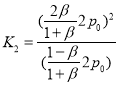 ,由K1=K2可得:β=
,由K1=K2可得:β=![]() ,即
,即![]() 的平衡分解率的表达式为
的平衡分解率的表达式为![]() 。
。

【题目】有a、b、c、d四个金属电极,G为电流计。有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小、b极质量增加 | 溶液中的SO42-向b极移动 | d极溶解c极有气体产生 | 电子从d极流向a极 |
由此可判断这四种金属的活动性顺序是
A. d>a>b>cB. a>b>c>dC. b>c>d>aD. a>b>d>c