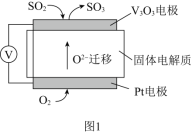
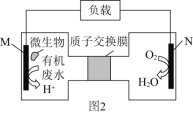
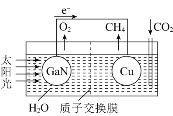
题目内容
【题目】有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
A.被氧化和被还原的离子数目比为![]()
B.该反应说明![]() 、
、![]() 、、
、、![]() 在溶液不能大量共存
在溶液不能大量共存
C.每![]() 发生氧化反应,转移
发生氧化反应,转移![]()
D.若利用该反应设计原电池,则负极反应为:![]()
【答案】C
【解析】
由题意可以确定,铁元素的化合价升高,N元素的化合价格下降低,则有8Fe2++NO3-+10H+=8Fe3++NH4++3H2O,该反应中氧化剂(NO3-)与还原剂(Fe2+)物质的量之比为1:8; 若有lmol NO3- 发生还原反应,转移电子数为8mol;若把该反应设计成原电池,负极反应为Fe2+-e-=Fe3+,据此分析。
A.反应中氧化剂![]() 与还原剂
与还原剂![]() 物质的量之比为1:8,故A正确;
物质的量之比为1:8,故A正确;
B.酸性条件下![]() 可氧化
可氧化![]() ,说明
,说明![]() 、
、![]() 、
、![]() 在溶液不能大量共存,故B正确;
在溶液不能大量共存,故B正确;
C.若有![]() 发生还原反应,转移电子数为8mol,而不是氧化,故C错误;
发生还原反应,转移电子数为8mol,而不是氧化,故C错误;
D.若把该反应设计成原电池,负极发生氧化反应,电极反应为![]() ,故D正确。
,故D正确。
故选C。

【题目】下列指定反应的化学用语表达正确的是( )
A | 质子交换膜氢氧燃料电池的负极反应 | O2+2H2O+4e﹣=4OH﹣ |
B | 用铁电极电解饱和食盐水 | 2Cl﹣+2H2O=Cl2↑+H2↑+20H﹣ |
C | 锅炉水垢中的CaSO4用饱和Na3CO3溶液浸泡 | CO32﹣+CaSO4=CaCO3+SO42﹣ |
D | KClO碱性溶液与Fe(OH)3反应制取K2FeO4 | 3ClO﹣+2Fe(OH)3=2FeO43﹣+3Cl﹣+4H++H2O |
A. AB. BC. CD. D
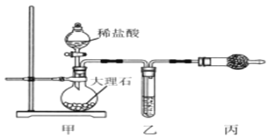
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9C)与Cl2 反应制备SnCl4装置如下图所示。
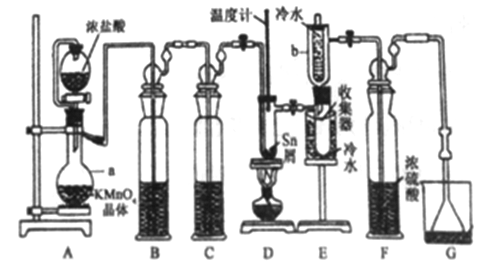
已知,① SnCl4在空气中极易水解生成SnO2xH2O;②SnCl2、SnCl4有关物理性质如下表。
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
回答下列问题:
(1)仪器a的名称是__________,其中发生反应的离子方程式为________。
(2)装置B、C 中盛装的试剂分别是_______、__________。
(3)当观察到装置F液面上方出现_____现象时才开始点燃酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的有:①加快氯气与锡反应,②__________。
(4)E装置中b的作用是___________。
(5)若制得产品中含有少量Cl2,则可采用下列_____(填字母)措施加以除去。
A.加入NaOH 萃取分液 B.加入足量锡再加热蒸馏
C.加入碘化钾冷凝过滤 D.加入饱和食盐水萃取
(6)可用滴定法测定最后产品的纯度。准确称取该样品mg加入到适量浓盐酸溶解,然后再加水稀释至250 mL,用移液管移取25.00 ml,稀释后的溶液于锥形瓶中,加入两滴淀粉溶液作指示制,用cmol/L 的KIO3 标准溶液进行滴定,平行滴定3 次,平均消耗V mL的标准溶液。已知滴定时发生的反应为:Sn2++IO3-+H+→Sn4++I2+H2O(未配平)。回答下列问题:
①判断达到滴定终点的现象为____________。
②产品中SnCl2(摩尔质量为M g/mol )的含量为____%(用含m、c、V、M 的代数式表示)。