题目内容
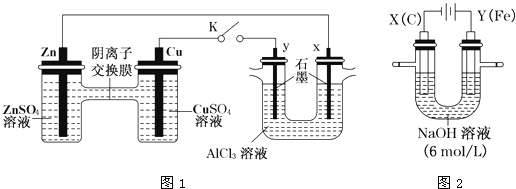
【题目】某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。
请回答:
Ⅰ.用图1所示装置进行第一组实验(K闭合)。
(1)Zn极为________极;实验过程中,SO42-____________(填“从左向右”、“从右向左”或“不”)移动。
(2)反应初期,y极的电极反应现象为________________;检验y极反应产物的方法是________________。
(3)Cu极的电极反应式为____________。
(4)Ⅱ.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。电解过程中,X极的电极反应式为__________。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=FeO42-+4H2O和4OH--4e-=2H2O+O2↑,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2该电池正极发生反应的电极反应式为________。
【答案】负 从右向左 有黄绿色气体产生 将湿润的淀粉碘化钾试纸靠近y极出气口,若试纸变蓝,则证明有氯气产生 ![]()
![]() (或
(或![]() ) 0.28
) 0.28 ![]()
【解析】
(1)图1中,左图中锌活泼性大于铜,所以锌为负极,原电池的外电路中电流由正极流向负极,硫酸根离子的移动方向与电流方向相反;
(2)铜为原电池的正极,则y极为电解池的阳极,阳极氯离子失去电子生成黄绿色的氯气;检验氯气用湿润的淀粉碘化钾试纸;
(3)铜为原电池的正极,阳离子得电子,发生还原反应;
(4)x电极连接的是电源的负极,则x为电解池的阴极,电解过程中x极水电离的氢离子得到电子生成氢气;
(5)根据阴阳极上转移电子数相等计算铁反应的质量;
(6)在碱性锌电池中,正极上得电子发生还原反应,据此并结合电池总反应写出该电池正极发生反应的电极反应式;
(1)根据图中装置可知,锌为该原电池的负极,铜为正极;电流在外电路中从铜流向锌,则电解质溶液中硫酸根离子由右向左移动,
故答案为:负;从右向左;
(2)根据图示可知,铜为原电池的正极,与电源正极相连的电极为阳极,所以y极为阳极,氯离子在y极失去电子生成氯气,会观察到有黄绿色气体生成;检验氯气的方法为:将湿润的碘化钾淀粉试纸靠近y极出气口处,若试纸变蓝,则证明有氯气生成;
故答案为:有黄绿色气体生成;将湿润的碘化钾淀粉试纸靠近y极出气口处,若试纸变蓝,则证明有氯气生成;
(3)铜电极上铜离子得到电子发生还原反应,电极反应式为:Cu2++2e=Cu,
故答案为:Cu2++2e=Cu;
(4)根据图示可知,X为电解池的阴极,发生的电极反应为:![]() (或
(或![]() ),
),
故答案为:![]() (或
(或![]() );
);
(5)X电极上析出的是氢气,Y电极上析出的是氧气,且Y电极失电子进入溶液,设铁质量减少为xg,根据转移电子数相等得![]()
解得:x=0.28,
故答案为:0.28;
(6)正极上高铁酸根离子得电子发生还原反应,反应方程式为:![]()
故答案为:![]() ;
;

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】物质分类是基本的化学思路。下表是几种常见物质的分类情况:
单质 | 氧化物 | 酸 | 碱 | 盐 |
Mg、S、C、N2 | CaO、CO2 | HCl、H3BO3 | KOH、NH3 H2O | KNO3、K2S |
回答下列问题
(1)下列物质可导电的是_____________;是电解质的是_______________。
①HCl(液态) ②HCl(稀溶液) ③KOH(固体) ④KOH(熔融状态) ⑤KOH(稀溶液)
(2)从上表选择两种物质,发生反应属于化合反应但不属于氧化还原反应,该反应的化学方程式为_____________。(任写一个即可)
(3)点燃时,镁可以在氮气中燃烧,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目__________________。
(4)酸按不同标准分类得到的结果是不同的。已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH-=B(OH)4-,则H3BO3属于_____元酸,其电离方程式为______。
(5)黑火药是我国古代伟大的科学发明,反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑,若生成22.4L N2(标准状况下),则被氧化的C是_________mol。
【题目】常用解热镇痛药对乙酰氨基苯酚(扑热息痛)为白色颗粒状晶体,易被空气氧化。实验室用对氨基苯酚乙酰化制备扑热息痛的一种方法如下:

查阅资料获得以下数据:
对氨基苯酚 | 醋酸酐 | 对乙酰氨基苯酚 | |
熔点/℃ | 189.6 ~ 190.2 | -73 | 169 ~ 171 |
密度/g·cm-3 | 1.2 | 1.1 | 1.3 |
相对分子质量 | 109 | 102 | 151 |
溶解性 | 溶于乙醇和水 | 溶于乙醇, 稍溶于水 | 易溶于乙醇和热水,溶于丙酮 |

实验过程:如图所示,在三颈烧瓶中加入对氨基苯酚10.9g,再加入30 mL水。打开仪器a下端的旋塞,缓慢滴加12 mL醋酸酐。搅拌并水浴加热,控制温度在80℃左右,充分反应后按如下流程进行操作。

回答下列问题:
(1)仪器a的名称是___________,仪器b的作用是_____________。
(2)步骤②洗涤晶体获得粗品时,选择的洗涤剂是______。(填标号)
A.乙醇 B.丙酮 C.热水 D.冷水
(3)减压过滤装置如图所示。步骤④减压过滤时,在吸滤瓶中要先加入适量NaHSO3,其作用是_________,该减压过滤需趁热进行,原因是_____________。

(4)步骤⑥中操作X为_______________。
(5)若最终得到9.8 g对乙酰氨基苯酚,则本实验的产率为______%。(保留1位小数)