题目内容
【题目】将一定质量的铜与100 mL一定物质的量浓度的硝酸反应,铜完全溶解时产生的NO和NO2混合气体在标准状况下的体积为11.2 L。待产生的气体全部释放后,向溶液中加入100mL 6 mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度是( )
A.6mol/LB.10mol/LC.11mol/LD.12 mol/L
【答案】C
【解析】
向反应后的混合溶液中加入氢氧化钠溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,由Na守恒n(NaNO3) = n(NaOH),根据氮原子守恒可知![]() ,再根据
,再根据![]() 计算。
计算。
向反应后的混合溶液中加入氢氧化钠溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,由Na守恒可得
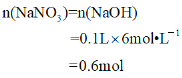
生成混合气体的物质的量为
![]()
根据氮原子守恒可知
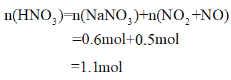
故原硝酸溶液的物质的量浓度为
![]()
故答案选C。

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目