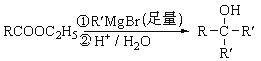题目内容
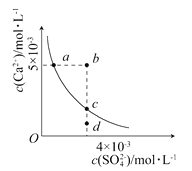
【题目】两个容积均为2L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是
N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是

A. N点的平衡常数为0.04
B. M、N两点容器内的压强:P(M)>2P(N)
C. 若将容器Ⅰ的容积改为1 L,T1温度下达到平衡时c(CO2)=0.25 mol·L-1
D. 若将容器Ⅱ改为绝热容器,实验起始温度为T1,达平衡时NO的转化率小于16.7%
【答案】AD
【解析】A. 根据图像,M点平衡时CO2的物质的量为1mol,
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始(mol/L)3 1 0 0
反应 0.5 0.5 0.25 0.5
平衡 2.5 0.5 0.25 0.5
则K=![]() =0.04,相同温度时,平衡常数相同,N点的平衡常数为0.04,故A正确;B. 起始时,容器Ⅰ中气体的物质的量为Ⅱ中的一半,平衡时,M容器内二氧化碳的物质的量为N点容器内二氧化碳的物质的量的2倍,则容器Ⅱ气体的物质的量为容器Ⅰ的2倍,则压强P(M)=2P(N),故B错误;C. 若将容器Ⅰ的容积改为1 L,T1温度下K=0.08,若达到平衡时c(CO2)=0.25 mol·L-1,
=0.04,相同温度时,平衡常数相同,N点的平衡常数为0.04,故A正确;B. 起始时,容器Ⅰ中气体的物质的量为Ⅱ中的一半,平衡时,M容器内二氧化碳的物质的量为N点容器内二氧化碳的物质的量的2倍,则容器Ⅱ气体的物质的量为容器Ⅰ的2倍,则压强P(M)=2P(N),故B错误;C. 若将容器Ⅰ的容积改为1 L,T1温度下K=0.08,若达到平衡时c(CO2)=0.25 mol·L-1,
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始(mol/L)1 3 0 0
反应 0.25 0.25 0.125 0.25
平衡 0.75 2.75 0.125 0.25
N点的平衡常数K=![]() ≠0.08,故C错误;D. 根据A的分析,在温度为T1时,NO的转化率=
≠0.08,故C错误;D. 根据A的分析,在温度为T1时,NO的转化率=![]() ×100%=16.7%,根据图像,升高温度,二氧化碳的物质的量减少,平衡逆向移动,说明正反应属于放热反应,若将容器Ⅱ改为绝热容器,实验起始温度为T1,平衡时温度高于T1,相当于原平衡逆向移动,NO的转化率减小,故D正确;故选AD。
×100%=16.7%,根据图像,升高温度,二氧化碳的物质的量减少,平衡逆向移动,说明正反应属于放热反应,若将容器Ⅱ改为绝热容器,实验起始温度为T1,平衡时温度高于T1,相当于原平衡逆向移动,NO的转化率减小,故D正确;故选AD。

 阅读快车系列答案
阅读快车系列答案【题目】蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成,由蛇纹石制取碱式碳酸镁的实验步骤如下:
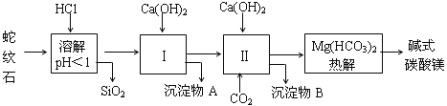
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 。
(2)进行Ⅰ操作时,控制溶液的pH=7~8(有关氢氧化物沉淀的pH见下表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致 溶解,产生 沉淀。
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 1.5 | 3.3 | 9.4 |
(3)从沉淀混合物A中提取红色氧化物作为颜料,先向沉淀物A中加入 (填加入物质的化学式),然后 (依此填写实验操作名称)。物质循环使用,能节约资源。上述实验中,可以循环使用的物质是 (填写物质的化学式)。
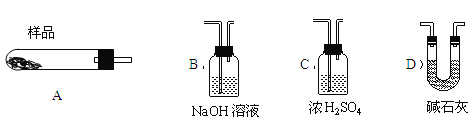
(4)现设计实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值。请写出下列实验步骤中所需要测定的项目(可用试剂:浓硫酸、碱石灰、氢氧化钠溶液、澄清石灰水):①样品称量,②高温分解,③ ,④ ,⑤MgO称量。
(5)从下列仪器(装有必要的试剂)中选择完成上述实验所必需的仪器,连接一套装置 (选择仪器代号,可重复使用,用“A→B→……→”表示)
(6)18.2g产品完全分解后,产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中a= ,b= ,c= 。
【题目】压强对合成氨反应具有重要的影响。下表是反应达到平衡时压强与NH3含量的一些实验数据:
压强/MPa | 10 | 20 | 30 | 60 | 100 |
NH3含量(体积分数)/% | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
从表中数据可以推断:随着压强增大,平衡时NH3含量
A. 增加 B. 减少 C. 先增加,后减 D. 先减少,后增加