题目内容
【题目】硫酸是重要的化工原料,我国主要采用接触法生产硫酸,主要过程如下:
FeS2 ![]() SO2
SO2 ![]() SO3
SO3 ![]() H2SO4
H2SO4
回答下列问题:
(1)基态V原子的电子排布式为________,基态Fe原子核外未成对电子数为______。
(2)组成H2SO4的元素中,电负性由大到小的顺序是________,SO2分子的VSEPR模型为________。
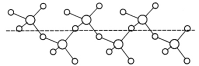
(3)固态SO3能以无限长链形式存在(如图所示)。其中S原子的杂化形式为______。长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是________(填“桥氧”或“端基氧”),原因是______________。
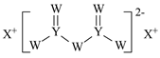
(4)绿矾是一种重要的硫酸盐,其组成可写成[Fe(H2O)6]2+[SO4(H2O)]2-,水合阴离子中H2O通过氢键与SO42-中的O原子相联结,按图示画出含氢键的水合阴离子:______________。

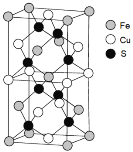
(5)一种含Fe、Cu、S三种元素的矿物晶胞如图所示,属于四方晶系(晶胞底面为正方形)。S2-的配位数为______。若晶胞的底面边长为a pm,高为b pm,晶体密度为ρ g/cm3,则阿伏加德罗常数可表示为____________(写出表达式)。
【答案】[Ar]3d34s2 4 O>S>H 平面三角形 sp3 桥氧 端基氧与硫原子形成双键,桥氧为硫氧单键,硫氧单键键长比硫氧双键大 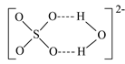 4
4 ![]()
【解析】
(1)V原子为23号元素,基态原子核外有23个电子,所以电子排布式为:[Ar]3d34s2;基态Fe原子核外电子排布式为1s22s22p63s23p63d64s2,3d轨道有4个电子未成对;
(2)非金属性越强,电负性越大,所以H、S、O三种元素电负性由大到小为O>S>H;二氧化硫分子中心原子价层电子对数为![]() =3,所以为sp2杂化,其VSEPR模型为平面三角形;
=3,所以为sp2杂化,其VSEPR模型为平面三角形;
(3)根据固体SO3的结构可知每个S原子形成4个σ键,价层电子对数为4,所以为sp3杂化;端基氧与硫原子形成双键,桥氧为硫氧单键,硫氧单键键长比硫氧双键大,所以桥氧化学键键长更大;
(4)氢键结合的情况可用X-H…Y表示,所以含氢键的水合阴离子为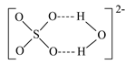 ;
;
(5)根据晶胞示意图可知S2-连接两个亚铁离子和两个铜离子,所以S2-的配位数为4;根据均摊法晶胞中S2-的个数为8,Fe2+的个数为![]() ,Cu2+个数为
,Cu2+个数为![]() =4,所以晶胞的质量m=
=4,所以晶胞的质量m=![]() ,晶胞体积V=a2b pm3= a2b×10-30 cm3,所以晶胞的密度ρ=
,晶胞体积V=a2b pm3= a2b×10-30 cm3,所以晶胞的密度ρ=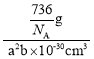 ,可解得NA=
,可解得NA=![]() 。
。