题目内容
【题目】(1)根据反应![]() ,回答下列问题:
,回答下列问题:
①用双线桥法标出该反应中电子转移的方向和数目:______。
②该反应中______元素被还原,______元素被氧化。
③在该反应中,若有![]() 电子发生转移,在标准状况下,可生成
电子发生转移,在标准状况下,可生成![]() 的体积为_____L。
的体积为_____L。
(2)配平化学方程式且回答下列问题:
①______ ![]() ______
______![]() ___
___![]() _____
_____![]() ___ Cl2 ___H2O
___ Cl2 ___H2O
②若生成![]() ,则被氧化的HCl是_________mol,
,则被氧化的HCl是_________mol,
(3)已知反应:2H2S+H2SO3=2H2O +3S,若氧化产物比还原产物多![]() ,则同时会生成水的质量为 ______ g。
,则同时会生成水的质量为 ______ g。
【答案】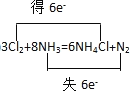 Cl N 1.12 2 16 2 2 5 8 2 1.8
Cl N 1.12 2 16 2 2 5 8 2 1.8
【解析】
(1)①在该反应中,Cl元素的化合价由0降低为-1价,部分N元素的化合价由-3价升高为0价,当3mol氯气和8mol氨气发生反应时,转移电子物质的量为6mol,据此可用双线桥标出电子转移的方向和数目;
②该反应中Cl元素的化合价降低,得电子,被还原,N元素的化合价升高,失电子,被氧化;
③N元素化合价由3价升高为0,当3mol氯气和8mol氨气发生反应生成1mol氮气时,转移电子物质的量为6mol,当反应过程中有0.3mol电子转移时,有0.05mol氮气生成;
(2)①反应中高锰酸钾中+7价锰降为氯化锰中+2价,降价数为5,得到5mol电子,氯化氢中-1价氯化合价升高为氯气中0价,升高为1,生成1mol氯气失去2mol电子,依据氧化还原反应中得失电子守恒、原子个数守恒配平方程式;
②依据方程式2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O,生成氯气的氯化氢是被氧化的,生成1mol氯气转移2mol电子,被氧化的氯化氢物质的量为2mol;
(3)反应中H2S中S氧化化合价升高,SO2中S元素化合价降低,氧化产物为2mol,还原产物为1mol,此时氧化产物比还原产物多32g,据此进计算。
(1)①在该反应中,Cl元素的化合价由0降低为-1价,部分N元素的化合价由-3价升高为0价,当3mol氯气和8mol氨气发生反应时,转移电子物质的量为6mol,则用双线桥标出电子转移的方向和数目可为 ;
;
故答案为: ;
;
②该反应中Cl元素的化合价降低,得电子,被还原,N元素的化合价升高,失电子,被氧化;
故答案为:Cl;N;
③N元素化合价由3价升高为0,当3mol氯气和8mol氨气发生反应生成1mol氮气时,转移电子物质的量为6mol,当反应过程中有0.3mol电子转移时,有0.05mol氮气生成,标准状况下的体积为![]() ;
;
故答案为:1.12;
(2)①该反应中,高锰酸钾中+7价锰降为氯化锰中+2价,降价数为5,得到5mol电子,氯化氢中1价氯化合价升高为氯气中0价,升高为1,生成1mol氯气失去2mol电子,依据氧化还原反应中得失电子守恒,高锰酸钾系数为2,氯气系数为5,依据原子个数守恒,氯化锰系数为2,氯化钾系数为2,依据氯原子个数守恒氯化氢系数为16,水分子系数为8,所以方程式:2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O;
故答案为:2;16;2;2;5;8;
②71gCl2物质的量为![]() ,依据方程式2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O,生成氯气的氯化氢是被氧化的,则生成1mol氯气转移2mol电子,被氧化的氯化氢物质的量为2mol;
,依据方程式2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O,生成氯气的氯化氢是被氧化的,则生成1mol氯气转移2mol电子,被氧化的氯化氢物质的量为2mol;
故答案为:2;
(3)反应2H2S+SO2═3S↓+2H2O中,H2S中S元素化合价由-2升高为0,被氧化,得氧化产物,SO2中S元素化合价由+4降低为0,被还原,得还原产物,S单质既是氧化产物,也是还原产物,生成3molS时,氧化产物为2mol,还原产物为1mol,此时氧化产物比还原产物多32g,同时会生成水2mol,若氧化产物比还原产物多1.6g,同时会生成水0.1mol,质量是1.8g;
故答案为:1.8。

 名校课堂系列答案
名校课堂系列答案