题目内容
【题目】物质分类是基本的化学思路。下表是几种常见物质的分类情况:
单质 | 氧化物 | 酸 | 碱 | 盐 |
Mg、S、C、N2 | CaO、CO2 | HCl、H3BO3 | KOH、NH3 H2O | KNO3、K2S |
回答下列问题
(1)下列物质可导电的是_____________;是电解质的是_______________。
①HCl(液态) ②HCl(稀溶液) ③KOH(固体) ④KOH(熔融状态) ⑤KOH(稀溶液)
(2)从上表选择两种物质,发生反应属于化合反应但不属于氧化还原反应,该反应的化学方程式为_____________。(任写一个即可)
(3)点燃时,镁可以在氮气中燃烧,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目__________________。
(4)酸按不同标准分类得到的结果是不同的。已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH-=B(OH)4-,则H3BO3属于_____元酸,其电离方程式为______。
(5)黑火药是我国古代伟大的科学发明,反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑,若生成22.4L N2(标准状况下),则被氧化的C是_________mol。
【答案】②④⑤ ①②③④ CaO+CO2![]() CaCO3
CaCO3 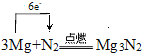 一 H3BO3+H2O
一 H3BO3+H2O![]() B(OH)4-+H+ 3
B(OH)4-+H+ 3
【解析】
(1)能导电的物质要么含自由移动的电子,要么含自由移动的离子;电解质应为酸、碱、盐及它们的熔融物。
(2)发生反应属于化合反应但不属于氧化还原反应,则必须为两种化合物间的反应,氧化物、酸、碱、盐间的反应属于复分解反应,属于化合反应的是酸性氧化物与碱性氧化物间的反应。
(3)镁在氮气中燃烧反应为3Mg+N2![]() Mg3N2,单线桥标出电子转移方向应由反应物中的Mg箭头指向N2中的N,数目为得电子总数或失电子总数。
Mg3N2,单线桥标出电子转移方向应由反应物中的Mg箭头指向N2中的N,数目为得电子总数或失电子总数。
(4)由H3BO3与足量NaOH溶液反应的离子方程式可以看出,H3BO3通过结合OH-而表现出酸性,H3BO3为弱酸,只能发生部分电离。
(5)由反应S+2KNO3+3C=K2S+N2↑+3CO2↑可以看出,参加反应的C为3mol时,生成1molN2。
(1)能导电的物质中应含有自由离子,则可导电的物质为②④⑤;电解质应为酸、碱、盐及它们的熔融物,则电解质是①②③④。答案为:②④⑤;①②③④;
(2)发生反应属于化合反应但不属于氧化还原反应,则必须为两种化合物间的反应,该反应的化学方程式为CaO+CO2![]() CaCO3。答案为:CaO+CO2
CaCO3。答案为:CaO+CO2![]() CaCO3;
CaCO3;
(3)镁在氮气中燃烧的用单线桥标出电子转移方向和数目的化学方程式为:
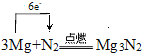 。答案为:
。答案为: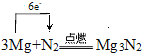 ;
;
(4)由H3BO3与足量NaOH溶液反应的离子方程式可以看出,H3BO3通过结合OH-而表现出酸性,则H3BO3属于一元酸,其电离方程式为H3BO3+H2O![]() B(OH)4-+H+。答案为:一;H3BO3+H2O
B(OH)4-+H+。答案为:一;H3BO3+H2O![]() B(OH)4-+H+;
B(OH)4-+H+;
(5)由反应S+2KNO3+3C=K2S+N2↑+3CO2↑可以看出,参加反应的C为3mol时,生成1molN2,若生成22.4L N2(标准状况下),则被氧化的C是3mol。答案为:3。