题目内容
【题目】CO是合成尿素、甲酸的原料。
(1)在100 kPa和T K下,由稳定单质生成1 mol化合物的焓变称为该物质在T K时的标准摩尔生成焓,用符号ΔHθ表示。已知石墨和一氧化碳的燃烧热分别为393.5 kJ·mol-1和283.0 kJ·mol-1,则CO(g)的ΔHθ=_________。
(2)合成尿素的反应:2NH3(g)+CO(g)CO(NH2)2(g)+H2(g) ΔH=-81.0 kJ·mol-1;T℃时,在体积为2 L 的恒容密闭容器中,将2 mol的NH3和1 mol CO混合反应,5 min时,NH3的转化率为80%。则0~5 min平均反应速率为v(CO)=_________。
已知:
温度/K | 398 | 498 | … |
平衡常数(K) | 126.5 | K1 | … |
则:K1________(填“>”或“<”)126.5;其判断理由是__________。
(3)若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:
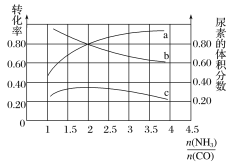
①若图中c表示平衡体系中尿素的体积分数,则a表示________的转化率。
②当![]() =________时,尿素含量最大;在该条件下,对于该反应既能增大反应速率又能使平衡正向移动的措施是_____(写一种)。
=________时,尿素含量最大;在该条件下,对于该反应既能增大反应速率又能使平衡正向移动的措施是_____(写一种)。
【答案】-110.5kJ/mol 0.08mol/(Lmin) < 合成尿素的反应为放热反应,温度升高,平衡逆移,K减小 CO 2 按物质的量之比为2∶1再加入NH3和CO
【解析】
(1)依据燃烧热的定义,写出相应的热化学方程式,再利用盖斯定律计算;
(2)根据NH3的转化率计算NH3的消耗速率,再根据化学反应速率之比等于化学计量数之比计算CO的消耗速率;该反应为放热反应,根据温度对平衡的影响分析K的变化;
(3)①根据增大其中一种反应物的含量,可以提高另一种反应物的转化率,结合曲线a的变化分析判断;②曲线c表示平衡体系中尿素的体积分数,根据曲线c分析;在保持恒温恒容条件下,从压强和浓度角度考虑既能增大正反应速率又能使平衡正向移动的措施。
(1)石墨和一氧化碳的燃烧热△H分别为-393.5kJ/mol和-283.0kJ/mol,燃烧热的热化学方程式分别为:①C(s)+O2(g)═CO2(g) △H=-393.5kJmol-1,②CO(g)+![]() O2(g)═CO2(g) △H=-283.0kJmol-1,根据盖斯定律,将①-②得:C(s)+
O2(g)═CO2(g) △H=-283.0kJmol-1,根据盖斯定律,将①-②得:C(s)+![]() O2(g)═CO(g) △Hθ=-110.5 kJ/mol,CO(g)的△Hθ为-110.5 kJ/mol,故答案为:-110.5kJ/mol;
O2(g)═CO(g) △Hθ=-110.5 kJ/mol,CO(g)的△Hθ为-110.5 kJ/mol,故答案为:-110.5kJ/mol;
(2)5min时,NH3的转化率为80%,则0-5min时,NH3的转化量为△c=![]() =0.8mol/L,则NH3的消耗速率为v(NH3)=
=0.8mol/L,则NH3的消耗速率为v(NH3)=![]() =0.16mol/(Lmin),根据化学反应速率之比等于化学计量数之比,则CO的消耗速率为v(CO)=
=0.16mol/(Lmin),根据化学反应速率之比等于化学计量数之比,则CO的消耗速率为v(CO)=![]() v(NH3)=0.08mol/(Lmin);该反应为放热反应,温度升高,平衡逆向移动。平衡常数减小,所以K1<126.5,判断理由是:合成尿素的反应为放热反应,温度升高,平衡逆移,K减小,故答案为:0.08mol/(Lmin);<;合成尿素的反应为放热反应,温度升高,平衡逆移,K减小;
v(NH3)=0.08mol/(Lmin);该反应为放热反应,温度升高,平衡逆向移动。平衡常数减小,所以K1<126.5,判断理由是:合成尿素的反应为放热反应,温度升高,平衡逆移,K减小,故答案为:0.08mol/(Lmin);<;合成尿素的反应为放热反应,温度升高,平衡逆移,K减小;
(3)①根据图象,曲线a的值随着![]() 的值增大而增大,增大其中一种反应物的含量,可以提高另一种反应物的转化率,所以增大NH3的含量能增大CO的转化率,相当于增大
的值增大而增大,增大其中一种反应物的含量,可以提高另一种反应物的转化率,所以增大NH3的含量能增大CO的转化率,相当于增大![]() 的值,所以曲线a表示CO的转化率,故答案为:CO;
的值,所以曲线a表示CO的转化率,故答案为:CO;
②曲线c表示平衡体系中尿素的体积分数,根据曲线c分析,当![]() =2时,2NH3(g)+CO(g)CO(NH2)2(g)+H2(g)反应恰好按照化学计量数进行,尿素含量最大;该反应属于气体体积减小的放热反应,在保持恒温恒容条件下,增大压强,即按物质的量之比为2∶1再加入NH3和CO,可以使正反应速率增大,又能使平衡正向移动,故答案为:2;按物质的量之比为2∶1再加入NH3和CO。
=2时,2NH3(g)+CO(g)CO(NH2)2(g)+H2(g)反应恰好按照化学计量数进行,尿素含量最大;该反应属于气体体积减小的放热反应,在保持恒温恒容条件下,增大压强,即按物质的量之比为2∶1再加入NH3和CO,可以使正反应速率增大,又能使平衡正向移动,故答案为:2;按物质的量之比为2∶1再加入NH3和CO。