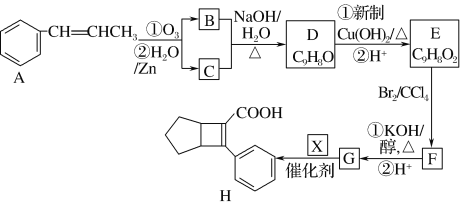
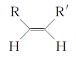
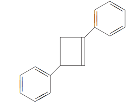
题目内容
【题目】在25.00 mL氢氧化钠溶液中逐滴加入0.2000 mol·L-1醋酸溶液,滴定曲线如图所示。
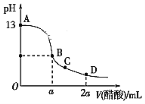
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式___________。
(2)该氢氧化钠溶液的物质的量浓度为_________mol·L-1。
(3)设在B点时酸碱恰好中和,则a=____________。
(4)若所加入的酸为0.2000 mol·L-1的盐酸,则D点时溶液的c(H+)=________。
【答案】OH-+CH3COOH=CH3COO-+H2O 0.1000 12.50 0.05000 mol·L-1
【解析】
(1)氢氧化钠溶液与醋酸溶液反应,生成醋酸钠和水,其中书写离子方程式时,醋酸为弱电解质,不能拆成离子形式,据此书写离子方程式;
(2)由滴定曲线可知25.00 mL氢氧化钠溶液的pH=13,即c(OH-)=0.1mol/L,由此可得氢氧化钠溶液的浓度;
(3)在B点时酸碱恰好中和,n(H+)=n(OH-);
(4)若所加入的酸为0.2000 mol·L-1的盐酸,D点时加入盐酸的物质的量为0.2000 mol·L-1×2×0.0125L=0.005mol,此时加入NaOH的物质的量为0.1000mol/L×0.025L=0.0025mol,可知D点时加入的盐酸过量,且过量的盐酸的物质的量为0.005mol-0.0025mol=0.0025mol,根据过量的盐酸的物质的量,计算出D点时溶液的c(H+)。
(1)氢氧化钠溶液与醋酸溶液反应,生成醋酸钠和水,离子方程式为:OH-+CH3COOH=CH3COO-+H2O;
(2)由滴定曲线可知25.00 mL氢氧化钠溶液的pH=13,即c(OH-)=0.1000mol/L,由此可得氢氧化钠溶液的浓度为0.1000mol/L;
(3)在B点时酸碱恰好中和,n(H+)=n(OH-),即0.025L×c(OH-)=0.2000mol/L×a×10-3L,c(OH-)=0.1000mol/L,那么a=![]() =0.0125L=12.5mL;
=0.0125L=12.5mL;
(4)若所加入的酸为0.2000 mol·L-1的盐酸,D点时加入盐酸的物质的量为0.2000 mol·L-1×2×0.0125L=0.005mol,此时加入NaOH的物质的量为0.1000mol/L×0.025L=0.0025mol,可知D点时加入的盐酸过量,且过量的盐酸的物质的量为0.005mol-0.0025mol=0.0025mol,即D点时溶液中n(H+)=0.0025mol,此时c(H+)=![]() =
=![]() =0.05000 mol·L-1。
=0.05000 mol·L-1。

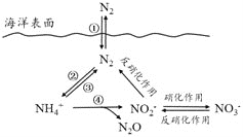
【题目】CO是合成尿素、甲酸的原料。
(1)在100 kPa和T K下,由稳定单质生成1 mol化合物的焓变称为该物质在T K时的标准摩尔生成焓,用符号ΔHθ表示。已知石墨和一氧化碳的燃烧热分别为393.5 kJ·mol-1和283.0 kJ·mol-1,则CO(g)的ΔHθ=_________。
(2)合成尿素的反应:2NH3(g)+CO(g)CO(NH2)2(g)+H2(g) ΔH=-81.0 kJ·mol-1;T℃时,在体积为2 L 的恒容密闭容器中,将2 mol的NH3和1 mol CO混合反应,5 min时,NH3的转化率为80%。则0~5 min平均反应速率为v(CO)=_________。
已知:
温度/K | 398 | 498 | … |
平衡常数(K) | 126.5 | K1 | … |
则:K1________(填“>”或“<”)126.5;其判断理由是__________。
(3)若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:
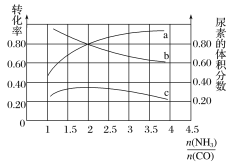
①若图中c表示平衡体系中尿素的体积分数,则a表示________的转化率。
②当![]() =________时,尿素含量最大;在该条件下,对于该反应既能增大反应速率又能使平衡正向移动的措施是_____(写一种)。
=________时,尿素含量最大;在该条件下,对于该反应既能增大反应速率又能使平衡正向移动的措施是_____(写一种)。
【题目】下列依据所给条件推出的结论不正确的是( )
选项 | 条件 | 结论 |
A | 在水溶液中或熔融状态下可以导电的化合物称为电解质 | CH3COOH水溶液中存在:CH3COOH |
B | 凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱 | H2O既是酸又是碱 |
C | Fe3Cl8可以改写为FeCl2·2FeC13 | Fe3I8可以改写为FeI·2FeI3 |
D | HCl在一定条件下能被MnO2氧化为Cl2 | HBr在一定条件下也能被MnO2氧化为Br2 |
A.AB.BC.CD.D