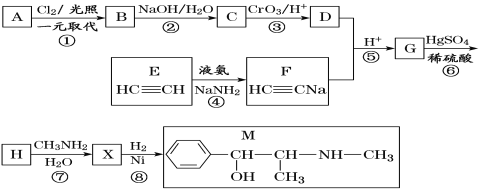
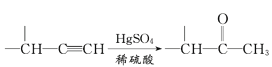
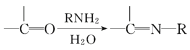
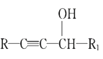题目内容
【题目】测定三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)晶体中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是_______________________________________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为______________________。
【答案】滴入最后一滴KMnO4溶液,溶液恰好变为浅紫红色,且半分钟内红色不消失 ![]() ×100%
×100%
【解析】
(1) 滴入最后一滴KMnO4溶液,溶液变成浅紫红色且半分钟内不变色是滴定的终点;
(2)亚铁离子变成铁离子,高锰酸根离子变成二价的锰离子,所以铁离子与高锰酸根离子的物质的量之比为5:1,所以铁元素的质量为:![]() ,据此计算。
,据此计算。
(1) 滴入最后一滴KMnO4溶液,溶液变成浅紫红色且半分钟内不变色是滴定的终点,故答案为:滴入最后一滴KMnO4溶液,溶液恰好变为浅紫红色,且半分钟内红色不消失;
(2)亚铁离子变成铁离子,高锰酸根离子变成二价的锰离子,所以铁离子与高锰酸根离子的物质的量之比为5:1,所以铁元素的质量为:![]() ,所以该晶体中铁的质量分数的表达式为:
,所以该晶体中铁的质量分数的表达式为:![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。

【题目】CO是合成尿素、甲酸的原料。
(1)在100 kPa和T K下,由稳定单质生成1 mol化合物的焓变称为该物质在T K时的标准摩尔生成焓,用符号ΔHθ表示。已知石墨和一氧化碳的燃烧热分别为393.5 kJ·mol-1和283.0 kJ·mol-1,则CO(g)的ΔHθ=_________。
(2)合成尿素的反应:2NH3(g)+CO(g)CO(NH2)2(g)+H2(g) ΔH=-81.0 kJ·mol-1;T℃时,在体积为2 L 的恒容密闭容器中,将2 mol的NH3和1 mol CO混合反应,5 min时,NH3的转化率为80%。则0~5 min平均反应速率为v(CO)=_________。
已知:
温度/K | 398 | 498 | … |
平衡常数(K) | 126.5 | K1 | … |
则:K1________(填“>”或“<”)126.5;其判断理由是__________。
(3)若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:
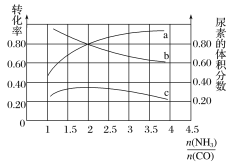
①若图中c表示平衡体系中尿素的体积分数,则a表示________的转化率。
②当![]() =________时,尿素含量最大;在该条件下,对于该反应既能增大反应速率又能使平衡正向移动的措施是_____(写一种)。
=________时,尿素含量最大;在该条件下,对于该反应既能增大反应速率又能使平衡正向移动的措施是_____(写一种)。