题目内容
【题目】实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的沸点见附表)。其实验步骤为:
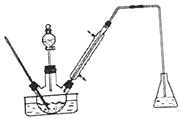
步骤1:将三颈瓶中的一定配比的无水AlCl3, 20mLl, 2 -二氯乙烷和20mL苯甲醛充分混合后.升温至60℃,缓慢滴加经H2SO4干燥过的液溴20mL,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,__________。
步骤3:有机相用10%NaHCO3溶液洗涤。经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1)实验装置中冷凝管的主要作用是__________,锥形瓶中的溶液应为__________。
(2)步骤1所加入的物质中,AlCl3是催化剂,请推测1, 2-二氯乙烷的作用__________。
(3)有同学建议将装置中温度计换成搅拌器,那么温度计应移到什么地方__________。
(4)步骤2后续操作是__________。
(5)步骤3中用10%的NaHCO3溶液洗涤的具体操作是__________。加入无水MgSO4固体的作用是__________。
(6)步骤4中采用减压蒸馏技术,是为了防止__________。
(7)最后收集到间溴苯甲醛10mL,则该实验的产率为__________。
附表相关物质的沸点(101kPa)

【答案】(1)冷凝回流;NaOH;(2)溶剂;(3)水浴中;(4)搅拌、静置、分液;
(5)将有机相转移到分液漏斗中,向其中加入10%的NaHCO3溶液,充分振荡后分液,重复2-3次;除去有机相的水(6)间溴苯甲醛被氧化;(7)43.2%。
【解析】试题分析:(1)因溴易挥发,为使溴充分反应,应进行冷凝回流,以增大产率,反应发生取代反应,生成间溴苯甲醛的同时生成HBr,用氢氧化钠溶液吸收,防止污染空气,故答案为:冷凝回流;NaOH;
(2)将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合,三种物质中无水AlCl3为催化剂,1,2-二氯乙烷为溶剂,苯甲醛为反应物,故答案为:溶剂;
(3)有同学建议将装置中温度计换成搅拌器,那么温度计可以移到水浴中,控制温度,故答案为:水浴中;
(4)步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液,故答案为:搅拌、静置、分液;
(5)步骤3中用10%的NaHCO3溶液洗涤的具体操作为将有机相转移到分液漏斗中,向其中加入10%的NaHCO3溶液,充分振荡后分液,重复2-3次;经洗涤的有机相含有水,加入适量无水MgSO4固体,可起到除去有机相的水的作用,
故答案为:将有机相转移到分液漏斗中,向其中加入10%的NaHCO3溶液,充分振荡后分液,重复2-3次;除去有机相的水;
(6)减压蒸馏,可降低沸点,避免温度过高,导致间溴苯甲醛被氧化,故答案为:间溴苯甲醛被氧化;
(7)20mL苯甲醛的质量为21.2g,物质的量为![]() =0.2mol,20mL液溴的质量为60g,物质的量为
=0.2mol,20mL液溴的质量为60g,物质的量为![]() =0.375mol,分液后溴过量,苯甲醛完全反应生成0.2mol间溴苯甲醛,质量为0.2mol×185g/mol=37g,10mL间溴苯甲醛的质量为16g,产率为
=0.375mol,分液后溴过量,苯甲醛完全反应生成0.2mol间溴苯甲醛,质量为0.2mol×185g/mol=37g,10mL间溴苯甲醛的质量为16g,产率为![]() ×100%=43.2%,故答案为:43.2%。
×100%=43.2%,故答案为:43.2%。

 阅读快车系列答案
阅读快车系列答案