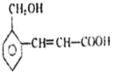
题目内容
【题目】据媒体报道,以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池(PEMFC) 常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是
①正极反应为:O2+4H++4e- ═2H2O
②负极反应为:2H2-4e- ═4H+
③总的化学反应为:2H2+O2![]() 2H2O
2H2O
④H+通过电解质向正极移动
A.①②③④ B.②③④ C.①②④ D.①②③
【答案】A
【解析】
试题分析:该燃料电池属于原电池,①正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4H++4e- ═2H2O,正确;②负极上氢气失电子生成氢离子,所以负极反应为:O2+4H++4e- ═2H2O,正确;③将正负极电极反应式相加得总的化学反应为:2H2+O2═2H2O,正确; ④该电池放电时,阳离子向负电荷较多的正极移动,所以H+通过电解质向正极移动,正确.故正确说法是①②③④,选项A符合题意。

【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | ||||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
请按要求回答下列问题。
(1)元素⑧的名称是______,元素⑧在周期表中所处位置___________。元素④的氢化物沸点高于⑦的氢化物沸点,原因是_________________________________________。
(2)④⑥⑦的氢化物按稳定性由弱到强的顺序是________________________(写氢化物的化学式)。
(3)元素②④形成原子个数比为1:2的化合物的电子式是 。
(4)元素②形成的一类氢化物称为烷烃,通式是___________,其中 (填分子式)有两种同分异构体,结构简式分别是____________________________________。
(5)用电子式表示⑤与⑦形成化合物的过程_________________________。