题目内容
11.下列设计的实验方案能达到实验目的是( )| A. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和Na2CO3溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe2+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
分析 A.NaOH过量,反应生成偏铝酸钠;
B.乙酸与碳酸钠反应后,与乙酸乙酯分层;
C.加入少量新制氯水了氧化亚铁离子;
D.相同条件下,只有催化剂不同.
解答 解:A.NaOH过量,反应生成偏铝酸钠,不能制备Al(OH)3悬浊液,故A错误;
B.乙酸与碳酸钠反应后,与乙酸乙酯分层,振荡后静置分液,并除去有机相的水可除杂,故B正确;
C.加入少量新制氯水了氧化亚铁离子,检验亚铁离子,应先加KSCN溶液,再加氯水,故C错误;
D.相同条件下,只有催化剂不同,试管中加入2mL5%H2O2和1mLFeCl3溶液反应速率快,则可探究催化剂对H2O2分解速率的影响,故D正确;
故选BD.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、混合物分离提纯、离子检验及影响反应速率的因素等,把握物质的性质及反应原理为解答的关键,注意实验的评价性分析,题目难度不大.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
1.25℃时,下列分子或离子在指定溶液中一定能大量共存的一组是( )
| A. | pH=1的溶液中:K+、Cr2O72-、C6H5OH、CO32- | |
| B. | c(H+)=1×10-13mol/L的溶液中:Cu2+、Na+、Cl-、SO42- | |
| C. | 0.1 mol/L NH4HCO3溶液中:K+、Na+、Cl-、NO3- | |
| D. | 0.1 mol/L Na2SiO3溶液中:K+、Cl-、NO3-、CO2 |
6.下列说法在一定条件下可以实现的是( )
①酸性氧化物与碱反应;
②弱酸与盐溶液反应可生成强酸;
③复分解反应既没有水生成,也没有沉淀和气体生成;
④两种酸溶液充分反应后的溶液呈中性;
⑤有单质参加的非氧化还原反应;
⑥两种含氧化合物反应的产物中有气体.
①酸性氧化物与碱反应;
②弱酸与盐溶液反应可生成强酸;
③复分解反应既没有水生成,也没有沉淀和气体生成;
④两种酸溶液充分反应后的溶液呈中性;
⑤有单质参加的非氧化还原反应;
⑥两种含氧化合物反应的产物中有气体.
| A. | ①②③④⑤⑥ | B. | ②④⑤⑥ | C. | ①②③⑤ | D. | ③④⑤⑥ |
1.下列有机物的结构简式,错误的是( )
| A. | 软脂酸 C17H35COOH | B. | 新戊烷 C(CH3)4 | ||
| C. | 甘氨酸 H2NCH2COOH | D. | 甘油 CH2(OH)CH(OH)CH2OH |
8.化合物M是从微生物中分离得到的,它显示出广谱抗菌活性.下列关于化合物M的说法中错误的是( )


| A. | 化合物M的分子式为C14H15NO7 | |
| B. | 化合物M能使酸性KMnO4溶液褪色 | |
| C. | 化合物M能发生加成反应,不能发生消去反应 | |
| D. | 1mol在NaOH溶液中反应,最多消耗4molNaOH |
5.化学与生活、环境密切相关,下列说法正确的是( )
| A. | 氢氧化钠和氢氧化铝都可治疗胃酸过多 | |
| B. | 葡萄酒中常含有一定量的S02用来防氧化和杀菌 | |
| C. | 酱油中含有三价铁可补充人体缺乏的铁元素 | |
| D. | 石油分馏的目的是为了获得乙烯、丙烯和丁二烯 |
6.如图所示是Zn和Cu形成的原电池,说法正确的是( )


| A. | 铜为负极,锌为正极 | B. | 正极反应为Zn-2e-=Zn2+ | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 原电池的反映本质是氧化还原反应 |
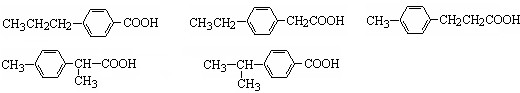 中任意两种.
中任意两种.

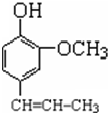 +CH3CH2Cl$\stackrel{一定条件下}{→}$
+CH3CH2Cl$\stackrel{一定条件下}{→}$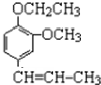 +HCl;
+HCl;