题目内容
6.下列叙述和推论正确的是( )| 选项 | 叙述 | 结论 |
| A | 由次氯酸可制得盐酸 | 酸性:HClO>HCl |
| B | 原电池中负极金属的活动性,比正极强 | 镁、铝作电极与NaOH溶液组成原电池时,镁作负极 |
| C | -OH可与Na反应生成H2 | 可通过加钠凝聚是否具有气泡产生的方法鉴别乙醇的水溶液和乙酸的水溶液 |
| D | 溶解度小的沉淀易向更小的沉淀转化 | 向AgCl悬浊液中滴加KI溶液可得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.次氯酸光照分解生成盐酸;
B.失去电子的金属作负极;
C.乙醇、乙酸均含-OH;
D.AgCl悬浊液中滴加KI溶液可得到AgI沉淀,发生沉淀的转化.
解答 解:A.次氯酸光照分解生成盐酸,但酸性为HCl>HClO,故A错误;
B.失去电子的金属作负极,则镁、铝作电极与NaOH溶液组成原电池时,Al作负极,故B错误;
C.乙醇、乙酸均含-OH,均与Na反应生成氢气,且均含水与Na反应生成氢气,则加钠凝聚是否具有气泡产生的方法不能鉴别,故C错误;
D.AgCl悬浊液中滴加KI溶液可得到AgI沉淀,发生沉淀的转化,则AgI的溶解度更小,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及酸性比较、原电池、物质的鉴别及沉淀的转化等,把握物质的性质及化学反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.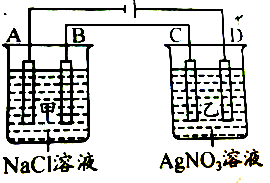 甲、乙两个容器中,分别加入0.1 mol•L -1的 NaCl溶液与0.1 mol•L-1的AgNO3溶液后,以 Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为 ( )
甲、乙两个容器中,分别加入0.1 mol•L -1的 NaCl溶液与0.1 mol•L-1的AgNO3溶液后,以 Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为 ( )
 甲、乙两个容器中,分别加入0.1 mol•L -1的 NaCl溶液与0.1 mol•L-1的AgNO3溶液后,以 Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为 ( )
甲、乙两个容器中,分别加入0.1 mol•L -1的 NaCl溶液与0.1 mol•L-1的AgNO3溶液后,以 Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为 ( )| A. | 2:2:4:1 | B. | 2:3:4:1 | C. | 1:4:2:2 | D. | 1:1:1:1 |
11.X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素最高价氧化物对应水化物化学式分别为H2X04和HY04.R、M同主族,R与冷水即可反应,M与热水反应缓慢.下列关系正确的是( )
| A. | 原子半径X>Y | B. | 氢化物稳定性H2X>HY | ||
| C. | 原子核内质子数R<M | D. | 溶液碱性ROH<MOH |
15.体积、物质的量的浓度均相等的NaCl和NaF两份溶液中阴离子总数关系正确的是( )
| A. | 前者多 | B. | 相等 | C. | 后者多 | D. | 无法判断 |
1.常温下,下列有关离子浓度及pH大小的比较,正确的是( )
| A. | NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4溶液浓度由大到小的顺序号:③>②>① | |
| B. | 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 若难溶电解质溶解度:A(OH)m大于B(OH)n,则Ksp也一定是前者大 | |
| D. | pH=4浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(104-10-10)mol/L |
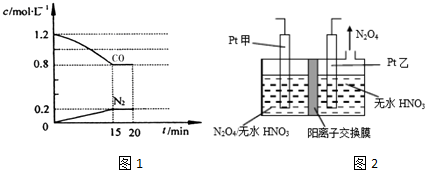
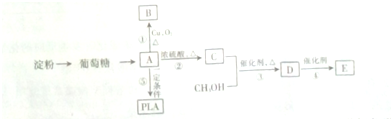
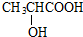 C中所含官能团的名称是羧基、碳碳双键
C中所含官能团的名称是羧基、碳碳双键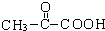 +2H2O反应④的化学方程式为n CH2=CHCOOCH3$\stackrel{催化剂}{→}$
+2H2O反应④的化学方程式为n CH2=CHCOOCH3$\stackrel{催化剂}{→}$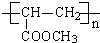
 +(n-1)H2O
+(n-1)H2O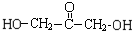 、
、 .
.