题目内容
11.X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素最高价氧化物对应水化物化学式分别为H2X04和HY04.R、M同主族,R与冷水即可反应,M与热水反应缓慢.下列关系正确的是( )| A. | 原子半径X>Y | B. | 氢化物稳定性H2X>HY | ||
| C. | 原子核内质子数R<M | D. | 溶液碱性ROH<MOH |
分析 X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素最高价氧化物对应水化物化学式分别为H2X04和HY04,X、Y最高正化合价分别为+6、+7,则X为S元素,Y为Cl,R、M同主族,R与冷水即可反应,M与热水反应缓慢,金属性R>M,R为Na、M为Li,结合元素周期律解答.
解答 解:X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素最高价氧化物对应水化物化学式分别为H2X04和HY04,X、Y最高正化合价分别为+6、+7,则X为S元素,Y为Cl,R、M同主族,R与冷水即可反应,M与热水反应缓慢,金属性R>M,R为Na、M为Li.
A.X为S元素,Y为Cl,同周期随原子序数增大,原子半径减小,故原子半径X>Y,故A正确;
B.非金属性S<Cl,故氢化物稳定性H2S<HCl,故B错误;
C.R、M同主族,R与冷水即可反应,M与热水反应缓慢,金属性R>M,同一主族元素,元素金属性随着原子序数增大而增强,故质子数R>M,故C错误;
D.R为Na、M为Li,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性NaOH>LiOH,故D错误,
故选:A.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握,难度中等.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案
相关题目
1.下列说法中正确的是( )
| A. | 饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大 | |
| B. | AgCl悬浊液中存在平衡:AgCl(s)═Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 | |
| C. | AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI) | |
| D. | 硬水中含有较多的Ca2+?Mg2+?HCO3-、SO42-,加热煮沸可以完全除去其中的Ca2+?Mg2+ |
2.下列图示的实验操作不能实现相应实验目的是( )
| A. |  证明装置的气密性良好 | |
| B. | 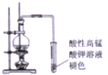 证明乙醇与浓H2SO4共热生成了大量乙烯 | |
| C. |  证明SO2有还原性 | |
| D. |  用饱和食盐水与CaC2制备并收集C2H2 |
6.下列叙述和推论正确的是( )
| 选项 | 叙述 | 结论 |
| A | 由次氯酸可制得盐酸 | 酸性:HClO>HCl |
| B | 原电池中负极金属的活动性,比正极强 | 镁、铝作电极与NaOH溶液组成原电池时,镁作负极 |
| C | -OH可与Na反应生成H2 | 可通过加钠凝聚是否具有气泡产生的方法鉴别乙醇的水溶液和乙酸的水溶液 |
| D | 溶解度小的沉淀易向更小的沉淀转化 | 向AgCl悬浊液中滴加KI溶液可得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
16.已知W、X、Y、Z为原子序数依次增大的短周期主族元素,X、Y、Z同周期,W、Z同主族,其中X、Y为金属元素,W与Y的原子序数相差5,下列说法正确的是( )
| A. | X离子的氧化性大于Y离子 | B. | W的气态氢化物的稳定性比Z的弱 | ||
| C. | 含Y的盐溶液一定显酸性 | D. | X离子的半径小于W离子 |
3.只用一种试剂即可鉴别乙醇、乙醛、乙酸、甲酸等有机物的溶液,这种试剂是( )
| A. | 新制生石灰 | B. | 新制氢氧化铜 | C. | 浓溴水 | D. | 银氨溶液 |
6. 甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.
甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.
(1)在一定温度下,向1L密闭容器中充入1mol CO和2mo1H2,发生上述反应,10分钟时反应达平衡,此时CO的转化率为50%.
①前10分钟生成甲醇的平均反应速率为0.05mol/(L.min);已知该反应在低温下能自发进行,则反应的△H为<(填“>”、“<”或“=”)0.
②下列关于上述反应的叙述,不正确的是BDE(填字母编号).
A.缩小容器的体积,平衡将向右移动,c(CO)将变大
B.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
C.恒温、恒容条件下,容器内的压强不发生变化则该反应达到平衡状态
D.反应过程中生成CH3OH的速率与消耗CO的速率相等则该反应达到平衡状态
E.使用合适的催化剂能缩短达到平衡的时间并提高CO的转化率
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均1mol)与CO平衡转化率的关系如图1所示.
①在上述三种温度中,曲线Z对应的温度是270℃.
②利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K=4.
(3)利用甲醇与水蒸气催化重整可获得清洁能源氢气,已知:
CH3OH (g)+$\frac{1}{2}$O2 (g)?CO2(g)+2H2 (g)△H1=-192.9kJ.mol-l
H2(g)+$\frac{1}{2}$O2(g)?H2O(g)△H2=-120.9kJ.mol-1
则甲醇与水蒸气催化重整反应:CH3OH (g)+H2O (g)?CO2(g)+3H2(g) 的焓变△H3=-70kJ.mol-1.
(4)有人设计甲醇一空气燃料电池的示意图如图2所示,工作时负极的电极反应式可表示为CH3OH-6e-+8OH-=CO32-+6H2O.
若以该电池为电源,用石墨做电极电解200mL含有下列离子的溶液:
电解一段时间后,标况下当两极收集到相同体积的气体时,阳极上收集到氧气的质量为3.2g (忽略溶液体积的变化及电极产物可能存在的溶解现象).
 甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.
甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.(1)在一定温度下,向1L密闭容器中充入1mol CO和2mo1H2,发生上述反应,10分钟时反应达平衡,此时CO的转化率为50%.
①前10分钟生成甲醇的平均反应速率为0.05mol/(L.min);已知该反应在低温下能自发进行,则反应的△H为<(填“>”、“<”或“=”)0.
②下列关于上述反应的叙述,不正确的是BDE(填字母编号).
A.缩小容器的体积,平衡将向右移动,c(CO)将变大
B.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
C.恒温、恒容条件下,容器内的压强不发生变化则该反应达到平衡状态
D.反应过程中生成CH3OH的速率与消耗CO的速率相等则该反应达到平衡状态
E.使用合适的催化剂能缩短达到平衡的时间并提高CO的转化率
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均1mol)与CO平衡转化率的关系如图1所示.
①在上述三种温度中,曲线Z对应的温度是270℃.
②利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K=4.
(3)利用甲醇与水蒸气催化重整可获得清洁能源氢气,已知:
CH3OH (g)+$\frac{1}{2}$O2 (g)?CO2(g)+2H2 (g)△H1=-192.9kJ.mol-l
H2(g)+$\frac{1}{2}$O2(g)?H2O(g)△H2=-120.9kJ.mol-1
则甲醇与水蒸气催化重整反应:CH3OH (g)+H2O (g)?CO2(g)+3H2(g) 的焓变△H3=-70kJ.mol-1.
(4)有人设计甲醇一空气燃料电池的示意图如图2所示,工作时负极的电极反应式可表示为CH3OH-6e-+8OH-=CO32-+6H2O.
若以该电池为电源,用石墨做电极电解200mL含有下列离子的溶液:
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
