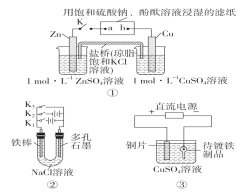
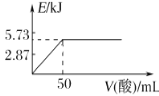
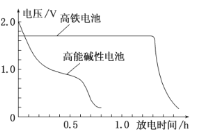
题目内容
【题目】硝酸盐被广泛用作肥料和氧化剂。有学者最新研究发现氮在ZnFe0.4Co1.6O4上直接电化学氧化可生成硝酸盐。回答下列问题:
(1)Fe、Co、Ni均位于元素周期表第_________族,其中基态Ni原子的核外电子排布式为_________;Zn与Co的第一电离能I1(Zn)__________(填“<”或“>”)I1(Co)。
(2)图1是一种钴(Co)金属催化剂的结构,其中六元环上的N原子的杂化方式为_________;NH3、PH3中沸点更高的是_________,原因是_____________________________________。
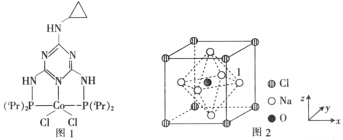
(3)一种由O、Na、C1元素构成的良好的离子导体,具有反钙钛矿晶体结构(如图2),则其化学式为_______________________,设其晶胞边长为anm,NA为阿伏加德罗常数的值,1号Na原子的坐标为(1,0.5,0.5),则沿y轴向原点投影至x-z平面,坐标为(0.5,0.5)的原子有_______个,该晶胞的密度为_________________g·cm-3。
【答案】Ⅷ [Ar]3d84s2 > sp2 NH3 NH3分子间能形成氢键 Na3OCl 3 ![]()
【解析】
(1)Fe、Co、Ni均位于元素周期表的第四周期Ⅷ族,其中Ni为28号,其基态Ni原子的核外电子排布式为[Ar]3d84s2;基态Zn原子的核外电子排布式为[Ar]3d104s2,d能级全充满,较稳定,基态Co原子的核外电子排布式为[Ar]3d74s2,d能级未达到全充满,故第一电离能I1(Zn)>I1(Co);
(2)钴(Co)金属催化剂的结构中,六元环上的N原子的杂化方式为sp2;NH3分子之间存在氢键,所以NH3的熔沸点在同主族元素氢化物中是反常的,所以NH3、PH3中沸点更高的是NH3;
(3)根据反钙钛矿晶体结构可计算出其一个晶胞中的各原子的个数,Cl:![]() ,Na:
,Na:![]() ,O:
,O:![]() ,所以反钙钛矿的化学式为Na3OCl;晶胞中,1号Na原子的坐标为(1,0.5,0.5),则沿y轴向原点投影至x-z平面,坐标为(0.5,0.5)的原子有:Na(0.5,0,0.5)、Na(0.5,1,0.5)、O(0.5,0.5,0.5),共3个;晶胞边长为a nm,即为a×10-7cm,NA为阿伏加德罗常数的值,所以该晶胞的密度为
,所以反钙钛矿的化学式为Na3OCl;晶胞中,1号Na原子的坐标为(1,0.5,0.5),则沿y轴向原点投影至x-z平面,坐标为(0.5,0.5)的原子有:Na(0.5,0,0.5)、Na(0.5,1,0.5)、O(0.5,0.5,0.5),共3个;晶胞边长为a nm,即为a×10-7cm,NA为阿伏加德罗常数的值,所以该晶胞的密度为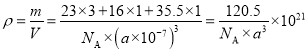 g·cm-3。
g·cm-3。

 阅读快车系列答案
阅读快车系列答案