题目内容
【题目】高铁电池是以高铁酸盐(K2FeO4、BaFeO4等)为材料的新型可充电电池,这种电池能量密度大、体积小、重量轻、污染低。电池的总反应为:3Zn+2![]() +8H2O
+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4OH-,下图是高铁电池与普通的高能碱性电池的使用电压对比。下列有关高铁电池的判断错误的是
3Zn(OH)2+2Fe(OH)3+4OH-,下图是高铁电池与普通的高能碱性电池的使用电压对比。下列有关高铁电池的判断错误的是
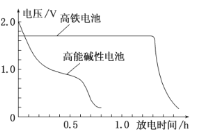
A.放电过程中正极区域电解液pH升高
B.高铁电池比高能碱性电池电压稳定、放电时间长
C.充电时,每转移3mol电子就有1molFe(OH)3被氧化
D.放电时负极反应式为:Zn+2e-+2H2O=Zn(OH)2+2H+
【答案】D
【解析】
A.放电时,失电子化合价升高的金属为负极材料,负极反应为:3Zn-6e-+6OH-=3Zn(OH)2,放电时,正极上得电子发生还原反应,电池反应式减去负极电极反应式得到正极电极反应式:2![]() +6e-+8H2O=2Fe(OH)3+10OH-,正极区域电解液pH升高,故A正确;
+6e-+8H2O=2Fe(OH)3+10OH-,正极区域电解液pH升高,故A正确;
B.据图可以看出高铁电池比高能碱性电池电压稳定,放电时间长,故B正确;
C.充电时,在阳极上发生反应:2Fe(OH)3-6e-+10OH-=2![]() +8H2O,每转移3mol电子,则有1 mol Fe(OH)3被氧化,故C正确;
+8H2O,每转移3mol电子,则有1 mol Fe(OH)3被氧化,故C正确;
D.放电时,失电子化合价升高的金属为负极材料,根据总反应可知负极反应为:3Zn-6e-+6OH-=3Zn(OH)2,故D错误;
故答案为D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目