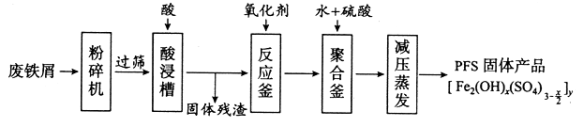
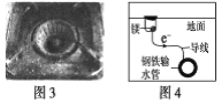
题目内容
【题目】下列说法正确的是( )
A.钠着火可以用水扑灭
B.氯气能与铁反应,所以液氯不宜贮存在钢瓶中
C.漂白粉露置于空气中会变质的反应涉及到氧化还原反应
D.FeCl3既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得
【答案】C
【解析】
A.钠可与水反应生成氢气,燃烧会更剧烈,所以钠着火不可以用水扑灭,故A错误;
B.常温下,铁与氯气不反应,则液氯可贮存在钢,故B错误;
C.漂白粉露置于空气中会变质的的原因是漂白粉中的次氯酸钙与空气中的二氧化碳及水蒸气反应生成碳酸钙和次氯酸,次氯酸不稳定易分解,发生反应为:Ca(ClO)2+CO2+H2O=CaCO3 ↓+2HClO,2HClO![]() 2HCl+O2↑,反应涉及到氧化还原反应,故C正确;
2HCl+O2↑,反应涉及到氧化还原反应,故C正确;
D.铁与氯气反应生成氯化铁,铁与盐酸反应生成氯化亚铁,故D错误;
答案选C。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】化工原料水合肼(N2H4·H2O)是一种强还原性的碱性液体。
Ⅰ.实验室用下图装置制备水合肼(N2H4·H2O)。
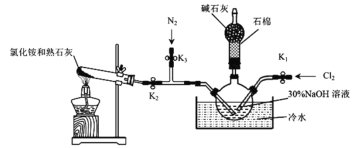
实验步骤:关闭K2、K3,打开K1,制备 NaClO;关闭K1、K2,打开K3,通入N2一段时间;关闭K3,打开K2,点燃酒精灯。回答下列问题:
(1)盛放碱石灰的仪器的名称为___________________。
(2)配制30%NaOH溶液时,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和_________。
(3)步骤2中通入N2一段时间的原因是____________________________________。
(4)水槽中放入冷水的目的是_____________________________________________。
(5)NH3与 NaClO反应生成N2H4·H2O的化学方程式为_______________________。
Ⅱ.已知:N2H4·H2O+2I2=N2↑+4HI+H2O,测定水合肼粗产品的纯度步骤如下:
a.称取N2H4·H2O粗产品(其它杂质不与I2反应)2.000g。
b.加水配成250.00mL溶液。
c.移出25.00mL置于锥形瓶中,滴加几滴淀粉溶液。
d.用0.3000mol·L-1的碘标准溶液进行滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗碘标准溶体积/mL | 20.24 | 20.02 | 19.98 |
f.数据处理。
(6)碘标准溶液盛放在____________(填“酸式”或“碱式”)滴定管中。在滴定管中装入碘标准溶的前一步,应进行的操作为_________,达到终点的现象是__________。
(7)消耗的碘标准溶平均体积为______mL,粗产品中水合肼的质量分数为______。
(8)判断下列操作对测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制碘标准溶液时,烧杯中的溶液有少量溅出,则测定结果___________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果___________。