题目内容
【题目】已知:①H+(aq)+OH-(aq)=H2O(l) ΔH1=-57.3kJ·mol-1,②H2(g)+![]() O2(g)=H2O(g) ΔH2=-241.8kJ·mol-1,下列有关说法正确的是( )
O2(g)=H2O(g) ΔH2=-241.8kJ·mol-1,下列有关说法正确的是( )
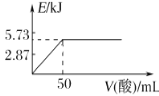
A.向含0.1molNaOH的溶液中加入一定体积的0.1mol·L-1乙二酸,反应中的能量变化如图所示
B.H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6kJ·mol-1
C.氢气的燃烧热为 ΔH=-241.8kJ·mol-1
D.氢气的燃烧热为 ΔH=-483.6kJ·mol-1
【答案】A
【解析】
A.乙二酸是弱酸,向含0. 1molNaOH的溶液中加入一定体积的0.1mol·L-1乙二酸,放出热量小于5.73 KJ,A正确;
B.H2SO4(aq)+ Ba (OH)2(aq) =BaSO4(s) + 2H2O(l),由于有硫酸钡沉淀生成,生成2mol H2O(l)时放出的热量大于114.6 kJ,B错误;
C.氢气的标准燃烧热是生成液态水放出的热量,但反应②中水为气态,C错误;
D.题目中不知道气态水转化为液态水放出的热量,所以本题无法求出氢气的标准燃烧热,D错误;
答案选A。

 名校课堂系列答案
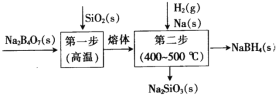
名校课堂系列答案【题目】化工原料水合肼(N2H4·H2O)是一种强还原性的碱性液体。
Ⅰ.实验室用下图装置制备水合肼(N2H4·H2O)。
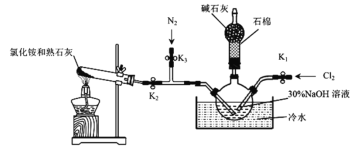
实验步骤:关闭K2、K3,打开K1,制备 NaClO;关闭K1、K2,打开K3,通入N2一段时间;关闭K3,打开K2,点燃酒精灯。回答下列问题:
(1)盛放碱石灰的仪器的名称为___________________。
(2)配制30%NaOH溶液时,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和_________。
(3)步骤2中通入N2一段时间的原因是____________________________________。
(4)水槽中放入冷水的目的是_____________________________________________。
(5)NH3与 NaClO反应生成N2H4·H2O的化学方程式为_______________________。
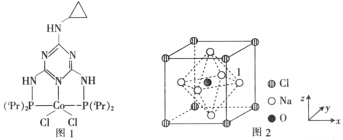
Ⅱ.已知:N2H4·H2O+2I2=N2↑+4HI+H2O,测定水合肼粗产品的纯度步骤如下:
a.称取N2H4·H2O粗产品(其它杂质不与I2反应)2.000g。
b.加水配成250.00mL溶液。
c.移出25.00mL置于锥形瓶中,滴加几滴淀粉溶液。
d.用0.3000mol·L-1的碘标准溶液进行滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗碘标准溶体积/mL | 20.24 | 20.02 | 19.98 |
f.数据处理。
(6)碘标准溶液盛放在____________(填“酸式”或“碱式”)滴定管中。在滴定管中装入碘标准溶的前一步,应进行的操作为_________,达到终点的现象是__________。
(7)消耗的碘标准溶平均体积为______mL,粗产品中水合肼的质量分数为______。
(8)判断下列操作对测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制碘标准溶液时,烧杯中的溶液有少量溅出,则测定结果___________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果___________。
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化