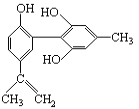
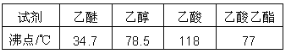
题目内容
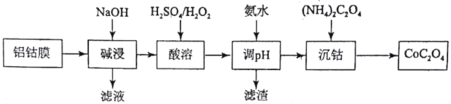
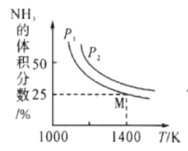
【题目】在一体积不变的密闭容器中发生化学反应:Fe2O3(s)+2NH3(g)![]() 2Fe(s)+N2(g)+3H2O(g) △H,实验测得化学平衡时的有关变化曲线如图所示。已知:平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。下列说法不正确的是( )
2Fe(s)+N2(g)+3H2O(g) △H,实验测得化学平衡时的有关变化曲线如图所示。已知:平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。下列说法不正确的是( )
A.NH3是正反应的还原剂
B.气体压强P2>P1
C.平衡后再充入一定量NH3,则平衡左移,NH3的体积分数减小
D.M点的平衡常数Kp=![]()
【答案】C
【解析】
由题图可知,随温度升高,氨的体积分数降低,平衡正向移动,正反应是吸热反应,该反应的△H>0,升温平衡正向移动;Fe2O3(s) +2NH3(g)![]() 2Fe(s) +N2(g) +3H2O(g)是气体体积增大的反应,加压平衡逆向移动。
2Fe(s) +N2(g) +3H2O(g)是气体体积增大的反应,加压平衡逆向移动。
A.正反应中,由NH3转化为N2,可见N由-3价变为0价,NH3是正反应的还原剂,A正确;
B.由于Fe2O3(s) +2NH3(g)![]() 2Fe(s) +N2(g) +3H2O(g)是气体体积增大的反应,加压平衡逆向移动,氨的体积分数增大,气体压强p2 >p1, B正确;
2Fe(s) +N2(g) +3H2O(g)是气体体积增大的反应,加压平衡逆向移动,氨的体积分数增大,气体压强p2 >p1, B正确;
C.平衡后再充入一定量NH3,容器体积不变,则相当于增大NH3的浓度,则平衡右移,NH3的体积分数减小, C错误;
D.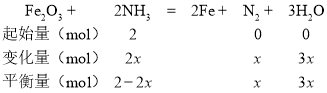
假设起始通入2mol NH3,M点时氨气的体积分数为25%,得到(2-2x)/(2+2x)=0.25,x=0.6,气体总物质的量=2mol+2x mol=3.2mol,图中M点的平衡常数为:
Kp=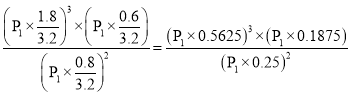 ,D正确;
,D正确;
答案选C。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g) ![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)/(mol·L-1) | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | c |
下列判断不正确的是
A. HI的平衡浓度:a=b>0.004,c=0.008 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率大于20% D. 丙中条件下,该反应的平衡常数K=0.25