题目内容
【题目】下列化学方程式书写正确的是( )
A.苯酚钠溶液中通入少量二氧化碳:2![]() + CO2 + H2O
+ CO2 + H2O ![]() 2
2![]() + Na2CO3
+ Na2CO3
B.乙酸乙酯的制备:CH3COOH + CH3CH218OH![]() CH3COOCH2CH3 + H218O
CH3COOCH2CH3 + H218O
C.用铁作电极电解饱和氯化钠溶液:2NaCl + 2H2O![]() 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
D.1-丙醇与钠反应:2CH3CH2CH2OH + 2Na → 2CH3CH2CH2ONa + H2↑
【答案】D
【解析】
A. 苯酚钠溶液中通入少量二氧化碳生成碳酸氢钠:![]() + CO2 + H2O
+ CO2 + H2O ![]()
![]() + NaHCO3,故A错误;
+ NaHCO3,故A错误;
B. 乙酸乙酯的制备时,酸脱羟基醇脱氢:CH3COOH + CH3CH218OH![]() CH3CO18OCH2CH3 + H2O,故B错误;
CH3CO18OCH2CH3 + H2O,故B错误;
C. 用铁作电极电解饱和氯化钠溶液,铁作阳极时要溶解,被氧化,故C错误;
D. 1-丙醇与钠反应:2CH3CH2CH2OH + 2Na → 2CH3CH2CH2ONa + H2↑,故D正确;
故选D。

【题目】课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g)+3H2(g) ![]() 2NH3(g) △H<0,△S<0。
2NH3(g) △H<0,△S<0。
(1)下列关于工业合成氨的说法正确的是__________。
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂不仅可以加快反应速率还可以降低反应所需的温度
(2)一定温度下,在密闭容器中充入1molN2和3molH2并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的![]() ,则N2的转化率为______________。
,则N2的转化率为______________。
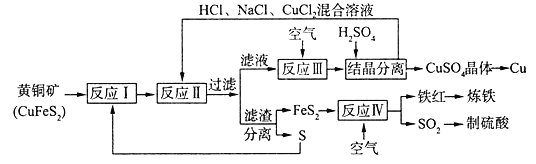
(3)工业上合成氨的部分工艺流程如下:
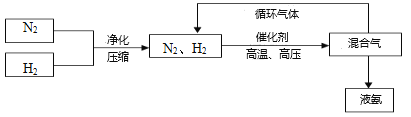
请用平衡移动原理来解释在流程中及时分离出氨气的原因_____________________________。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。
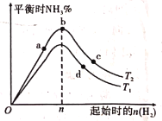
①图象中T2和T1的关系是:T2_______T1(填“>”“<”或“=”)
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是___________(填字母)。
(5)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
此条件下该反应的化学平衡常数K=_______________。
(6)氨氧化法是工业生产中制取硝酸的主要途径。
已知:N2(g)+3H2(g) ![]() 2NH3(g) △H= -92 kJ·mol-1
2NH3(g) △H= -92 kJ·mol-1
N2(g)+O2(g) ![]() 2NO(g) △H= +181 kJ·mol-1
2NO(g) △H= +181 kJ·mol-1
2H2(g)+O2 (g)![]() 2H2O(g) △H= -484 kJ·mol-1
2H2O(g) △H= -484 kJ·mol-1
写出氨气催化氧化生成NO和水蒸气的热化学方程式________________________________________。
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
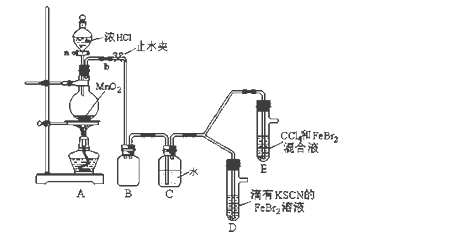
(1)①装置A中发生反应的离子方程式是_____________________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3 是一个可逆反应。
Fe(SCN)3 是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________溶液,若溶液颜色________,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释产生白色沉淀原因__________________、_______________________