ЬтФПФкШн
ЁОЬтФПЁПФГЛЏбЇПЮЭтаЁзщЮЊВтЖЈПеЦјжаCO2ЕФКЌСПЃЌНјааСЫШчЯТЪЕбщЃК
ЂйХфжЦ0.1000molЁЄL-1КЭ0.01000molЁЄL-1ЕФБъзМбЮЫсЁЃ
ЂкгУ0.1000molЁЄL-1ЕФБъзМбЮЫсЕЮЖЈЮДжЊХЈЖШЕФBa(OH)2ШмвК10.00mLЃЌНсЙћгУШЅбЮЫс19.60mLЁЃ
ЂлгУВтЖЈЕФBa(OH)2ШмвКЮќЪеЖЈСППеЦјжаЕФCO2ЁЃШЁBa(OH)2ШмвК10.00mLЃЌЗХШы100mLШнСПЦПРяМгЫЎжСПЬЖШЯпЃЌШЁГіЯЁЪЭКѓЕФШмвКЗХШыУмБеШнЦїФкЃЌВЂЭЈШы10LБъзМзДПіЯТЕФПеЦјЃЌеёЕДЃЌетЪБЩњГЩГСЕэЁЃ
ЂмЙ§ТЫЩЯЪіЫљЕУзЧвКЁЃ
ЂнШЁТЫвК20.00mLЃЌгУ0.01000molЁЄL-1ЕФбЮЫсЕЮЖЈЃЌгУШЅбЮЫс34.80mLЁЃЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉХфжЦБъзМбЮЫсЪБЃЌашгУЯТСаФФаЉвЧЦї?____ЃЛ
A.ЭаХЬЬьЦН B.ШнСПЦП C.ЫсЪНЕЮЖЈЙм D.СПЭВ E.ЩеБ F.НКЭЗЕЮЙм G.ВЃСЇАє
ЃЈ2ЃЉЕЮЖЈВйзїжаЃЌзѓЪж____ЃЌгвЪж____ЃЌблОІ____ЃЛ
ЃЈ3ЃЉBa(OH)2ШмвКЕФЮяжЪЕФСПХЈЖШЪЧ____ЃЛ
ЃЈ4ЃЉЙ§ТЫЫљЕУзЧвКЕФФПЕФЪЧ____ЃЛ
ЃЈ5ЃЉДЫПеЦјбљЦЗжаКЌCO2ЕФЬхЛ§ЗжЪ§ЮЊ____ЃЛ
ЃЈ6ЃЉБОЪЕбщжаЃЌШєЕквЛДЮЕЮЖЈЪБЪЙгУЕФЫсЪНЕЮЖЈЙмЮДОДІРэЃЌМДзЂШыЕкЖўжжБъзМбЮЫсЃЌВЂНјааЕкЖўДЮЕЮЖЈЃЌЪЙВтЖЈНсЙћ____(ЬюЁАЦЋДѓЁБЁАЦЋаЁЁБЛђЁАЮогАЯьЁБ)ЁЃ
ЁОД№АИЁПBЁЂCЁЂDЁЂEЁЂFЁЂG ПижЦЛюШћ вЁЖЏзЖаЮЦП зЂЪгзЖаЮЦПФкШмвКбеЩЋЕФБфЛЏ 0.0980molЁЄL-1 ЗжРыГіBaCO3ЃЌЗРжЙHClгыBaCO3ЗДгІ 0.025% ЦЋДѓ
ЁОНтЮіЁП
ЃЈ1ЃЉИљОнХфжЦвЛЖЈЮяжЪЕФСПХЈЖШЕФШмвКЕФХфжЦВНжшбЁдёвЧЦїЃЛ
ЃЈ2ЃЉИљОне§ШЗЕФЕЮЖЈЪЕбщВйзїЗНЗЈЭъГЩЃЛ
ЃЈ3ЃЉИљОнЗДгІЗНГЬЪНМАЕЮЖЈЪ§ОнНјааМЦЫуЃЛ
ЃЈ4ЃЉЗжРыГіЬМЫсБЕЃЌЗРжЙЬМЫсБЕгыбЮЫсЗДгІЃЌгАЯьЕЮЖЈНсЙћЃЛ
ЃЈ5ЃЉЧѓГіЖўбѕЛЏЬМЗДгІКѓЪЃгрЕФBa(OH)2ЃЌИљОнBa(OH)2ЕФЮяжЪЕФСПМЦЫуГіПеЦјжаCO2ЕФЮяжЪЕФСПМАЬхЛ§ЗжЪ§ЃЛ
ЃЈ6ЃЉЕкЖўДЮЕЮЖЈЪБЃЌЫсЪНЕЮЖЈЙмУЛгаДІРэЃЌЕМжТБъзМвКбЮЫсЕФХЈЖШЦЋДѓЃЌЯћКФЕФбЮЫсЕФЬхЛ§ЦЋаЁЃЌМЦЫуГіЕФЪЃгрЕФЧтбѕЛЏБЕЮяжЪЕФСПЦЋаЁЁЃ
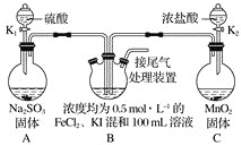
(1)ХфжЦвЛЖЈЮяжЪЕФСПХЈЖШЕФбЮЫсЪБЃЌВНжшгаМЦЫуЁЂЯЁЪЭЁЂзЊвЦЁЂЯДЕгЁЂЖЈШнЁЂвЁдШЕШЃЌашвЊвЧЦїгаЃКШнСПЦПЁЂСПЭВ(ЛђепЫсЪНЕЮЖЈЙм)ЁЂЩеБЁЂНКЭЗЕЮЙмМАВЃСЇАєЃЌМДBCDEFGЃЌ
ЙЪД№АИЮЊЃКBЁЂCЁЂDЁЂEЁЂFЁЂGЃЛ
(2)ЕЮЖЈВйзїЪБЃЌзѓЪжПижЦЛюШћЃЌгвЪжвЁЖЏзЖаЮЦПЃЌблОІзЂЪгзЖаЮЦПФкШмвКбеЩЋБфЛЏЃЌ
ЙЪД№АИЮЊЃКПижЦЛюШћЃЛвЁЖЏзЖаЮЦПЃЛзЂЪгзЖаЮЦПФкШмвКбеЩЋЕФБфЛЏЃЛ
(3)ИљОнЗДгІЗНГЬЪНЃКBa(OH)2+2HClЈTBaCl2+2H2OЃЌдђc[Ba(OH)2]ЁС10.00 mL=![]() ЁС0.1 mol/LЁС19.60 mLЃЌНтЕУc[Ba(OH)2]= 0.0980molЁЄL-1ЃЌ
ЁС0.1 mol/LЁС19.60 mLЃЌНтЕУc[Ba(OH)2]= 0.0980molЁЄL-1ЃЌ
ЙЪД№АИЮЊЃК0.0980 molЁЄL-1ЃЛ
(4)ЯТвЛВНашвЊгУбЮЫсЕЮЖЈгыЖўбѕЛЏЬМЗДгІКѓЪЃгрЕФЧтбѕЛЏБЕЃЌЮЊСЫЗРжЙBaCO3гыHClЗЂЩњЗДгІЃЌгАЯьЕЮЖЈНсЙћЃЌгІИУЗжРыГіBaCO3ЃЌ
ЙЪД№АИЮЊЃКЗжРыГіBaCO3ЃЌЗРжЙHClгыBaCO3ЗДгІЃЛ
(5)ЗЂЩњЕФЗДгІЗНГЬЪНЃКBa(OH)2+CO2ЈTBaCO3Ё§+H2OЃЌ20 mLТЫвКжаBa(OH)2ЕФЮяжЪЕФСПЮЊ34.80ЁС103ЁС0.01ЁС![]() mol=0.174ЁС103 molЃЌФЧУД100 mLТЫвКжагаBa(OH)2:100mLТЫвКжаКЌгаЕФЧтбѕЛЏБЕЕФЮяжЪЕФСПЮЊЃК
mol=0.174ЁС103 molЃЌФЧУД100 mLТЫвКжагаBa(OH)2:100mLТЫвКжаКЌгаЕФЧтбѕЛЏБЕЕФЮяжЪЕФСПЮЊЃК![]() =8.70ЁС104 molЃЌдгаЕФЧтбѕЛЏБЕЕФЮяжЪЕФСПЮЊЃК0.098mol/LЁС10ЁС103L=9.8ЁС104molЃЌдђПеЦјжаЖўбѕЛЏЬМЯћКФЕФЧтбѕЛЏБЕЕФЮяжЪЕФСПЮЊЃК9.8ЁС104mol8.70ЁС104mol=1.1ЁС104molЃЌn(CO2)=n[Ba(OH)2)]=1.1ЁС104molЃЌ
=8.70ЁС104 molЃЌдгаЕФЧтбѕЛЏБЕЕФЮяжЪЕФСПЮЊЃК0.098mol/LЁС10ЁС103L=9.8ЁС104molЃЌдђПеЦјжаЖўбѕЛЏЬМЯћКФЕФЧтбѕЛЏБЕЕФЮяжЪЕФСПЮЊЃК9.8ЁС104mol8.70ЁС104mol=1.1ЁС104molЃЌn(CO2)=n[Ba(OH)2)]=1.1ЁС104molЃЌ
ЖўбѕЛЏЬМЕФЬхЛ§ЗжЪ§ЮЊЃК![]() ЁС100%=0.025%ЃЌ
ЁС100%=0.025%ЃЌ
ЙЪД№АИЮЊЃК0.025%ЃЛ
(6)гЩгкЫсЪНЕЮЖЈЙмУЛгаДІРэЃЌЕМжТЕкЖўДЮЕЮЖЈЯћКФЕФБъзМвКбЮЫсЬхЛ§ЦЋаЁЃЌМЦЫуГіЕФЧтбѕЛЏБЕЮяжЪЕФСПЦЋаЁЃЌдђгыЖўбѕЛЏЬМЗДгІЕФЧтбѕЛЏБЕЮяжЪЕФСПЦЋДѓЃЌМЦЫуНсЙћЦЋДѓЃЌ
ЙЪД№АИЮЊЃКЦЋДѓЁЃ

ЁОЬтФПЁПЕЊЕФЛЏКЯЮяМШЪЧвЛжжзЪдДЃЌвВЛсИјЛЗОГдьГЩЮЃКІЁЃ
IЃЎАБЦјЪЧвЛжжживЊЕФЛЏЙЄдСЯЁЃ
ЃЈ1ЃЉNH3гыCO2дк120ЁуCЃЌДпЛЏМСзїгУЯТЗДгІЩњГЩФђЫиЃКCO2ЃЈgЃЉ+2NH3ЃЈgЃЉ![]() ЃЈNH2ЃЉ2COЃЈsЃЉ+H2OЃЈgЃЉЃЌІЄH= -x KJ/mol (x>0)ЃЌЦфЫћЯрЙиЪ§ОнШчБэЃК
ЃЈNH2ЃЉ2COЃЈsЃЉ+H2OЃЈgЃЉЃЌІЄH= -x KJ/mol (x>0)ЃЌЦфЫћЯрЙиЪ§ОнШчБэЃК
ЮяжЪ | NH3(g) | CO2(g) | CO(NH2)2(s) | H2O(g) |
1molЗжзгжаЕФЛЏбЇМќЖЯСбЪБашвЊЮќЪеЕФФмСП/KJ | a | b | z | d |
дђБэжаzЃЈгУx a b dБэЪОЃЉЕФДѓаЁЮЊ________ЁЃ
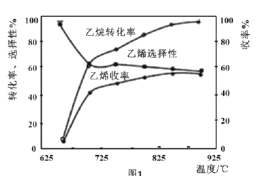
ЃЈ2ЃЉ120ЁцЪБЃЌдк2LУмБеЗДгІШнЦїжаГфШы3mol CO2гыNH3ЕФЛьКЯЦјЬхЃЌЛьКЯЦјЬхжаNH3ЕФЬхЛ§ЗжЪ§ЫцЗДгІЪБМфБфЛЏЙиЯЕШчЭМЫљЪОЃЌИУЗДгІЕНДяЦНКтЪБCO2ЕФЦНОљЗДгІЫйТЪЮЊ_____, ДЫЮТЖШЪБЕФЦНКтГЃЪ§ЮЊ_____ЁЃ
ЯТСаФмЪЙе§ЗДгІЕФЛЏбЇЗДгІЫйТЪМгПьЕФДыЪЉга___________.
Ђй МАЪБЗжРыГіФђЫи Ђк Щ§ИпЮТЖШ Ђл ЯђУмБеЖЈШнШнЦїжадйГфШыCO2 Ђм НЕЕЭЮТЖШ
ЂђЃЎЕЊЕФбѕЛЏЮяЛсЮлШОЛЗОГЁЃФПЧАЃЌЯѕЫсГЇЮВЦјжЮРэПЩВЩгУNH3гыгкNOдкДпЛЏМСДцдкЕФЬѕМўЯТзїгУЃЌНЋЮлШОЮязЊЛЏЮЊЮоЮлШОЕФЮяжЪЁЃФГбаОПаЁзщФтбщжЄNOФмБЛАБЦјЛЙдВЂМЦЫуЦфзЊЛЏТЪЃЈвбжЊХЈСђЫсдкГЃЮТЯТВЛбѕЛЏNOЦјЬхЃЉЁЃ
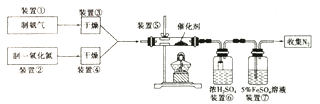
(lЃЉаДГізАжУЂнжаЗДгІЕФЛЏбЇЗНГЬЪН_________ЁЃ
(2ЃЉзАжУЂйКЭзАжУЂкШчЯТЭМЃЌвЧЦїAЕФУћГЦЮЊ_____ЃЌЦфжаЪЂЗХЕФвЉЦЗУћГЦЮЊ_______ЁЃ

зАжУЂкжаЃЌЯШдкЪдЙмжаМгШы2-3 СЃЪЏЛвЪЏЃЌзЂШыЪЪСПЯЁЯѕЫсЃЌЗДгІвЛЖЮЪБМфКѓЃЌдйШћЩЯДјгаЯИЭЫПЕФНКШћНјааКѓајЗДгІЃЌМгШыЪЏЛвЪЏЕФзїгУЪЧ________ЁЃ
ЃЈ3ЃЉзАжУЂожаЃЌаЁЖЮВЃСЇЙмЕФзїгУЪЧ______ЃЛзАжУЂпЕФзїгУЪЧГ§ШЅNO, NOгыFeSO4ШмвКЗДгІаЮГЩзиЩЋ[Fe(NO)]SO4ШмвКЃЌЭЌЪБзАжУЂпЛЙгУРДМьбщАБЦјЪЧЗёГ§ОЁЃЌШєАБЦјЮДГ§ОЁЃЌПЩЙлВьЕНЕФЪЕбщЯжЯѓЪЧ_________ЁЃ
ЁОЬтФПЁПЮоЛњЛЏКЯЮяПЩИљОнЦфзщГЩКЭаджЪНјааЗжРрЁЃ

ЃЈ1ЃЉЩЯЭМЫљЪОЕФЮяжЪЗжРрЗНЗЈУћГЦЪЧ____________ЁЃ
ЃЈ2ЃЉвдФЦЁЂМиЁЂЧтЁЂбѕЁЂЬМЁЂСђЁЂЕЊжаШЮСНжжЛђШ§жждЊЫизщГЩКЯЪЪЕФЮяжЪЃЌЗжБ№ЬюдкЯТБэжаЕФКсЯпЩЯЃК
ЮяжЪРрБ№ | Ыс | Мю | бЮ | бѕЛЏЮя | ЧтЛЏЮя |
ЛЏбЇЪН | ЂйHCl Ђк____ | Ђл____ ЂмBaЃЈOHЃЉ2 | ЂнNa2CO3 Ђо____ | ЂпCO2 ЂрNa2O | ЂсNH3 ЂтH2O2 |
ЃЈ3ЃЉаДГіЂпзЊЛЏЮЊЂнЕФЛЏбЇЗНГЬЪН__________ЁЃ
ЃЈ4ЃЉаДГіЪЕбщЪвгЩЂтжЦБИбѕЦјЕФЛЏбЇЗНГЬЪН______ЁЃ
ЃЈ5ЃЉЪЕбщЪвжЦБИЂпГЃгУ________КЭ________ЗДгІЃЌМьбщИУЦјЬхЕФЗНЗЈЪЧ________ЁЃ