题目内容
【题目】以葡萄糖为燃料的微生物燃料电池的结构如图所示。下列关于该电池的叙述不正确的是( )

A.该装置属于原电池
B.放电过程中,H+从负极区向正极区迁移
C.在电池反应中,每消耗1 mol氧气,理论上能生成11.2 L(标准状况)CO2
D.电池负极的电极反应式为C6H12O6+6H2O-24e-=6CO2↑+24H+
【答案】C
【解析】
A.该装置为以葡萄糖为燃料的微生物燃料电池,属于原电池,故A正确;
B.原电池内部阳离子应向正极移动,则放电过程中,H+从负极区向正极区迁移,故B正确;
C.正极反应式为O2+4e-+4H+=2H2O,则负极反应式为C6H12O6+6H2O-24e-=6CO2↑+24H+,对比可知,消耗1mol氧气生成1mol二氧化碳,标准状况下体积是22.4L,故C错误;
D.负极是葡萄糖失电子生成二氧化碳,电极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+,故D正确;
故答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】CO、CO2的应用和治理是当今社会的热点问题。CO工业上可用于高炉炼铁,发生如下反应:1/3Fe2O3(s) + CO(g)![]() 2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的正反应为_____反应(填“放热”或“吸热”),欲提高CO的平衡转化率,促进 Fe2O3的转化,可采取的措施是____(选填序号)
a.用更高效的催化剂 b.粉碎矿石,增大接触面积
c.及时吸收或移出CO2 d.增大反应体系的压强
(2)一定条件下,在容积一定的容器中,铁和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)△H>0,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时
FeO(s)+CO(g)△H>0,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时![]() 增大的是______(选填编号)。
增大的是______(选填编号)。
a.再加入一些铁粉 b.充入一定量CO
c.增大压强 d.升高温度
【题目】丙烷脱氢是工业生产丙烯的重要途径,其热化学方程式为![]()
![]() ,请回答下列相关问题。
,请回答下列相关问题。
![]() 下表为部分键能数据,据此可算出
下表为部分键能数据,据此可算出![]() ___________
___________![]() 。
。
化学键 |
|
|
|
|
键能 | 332 | 611 | 414 | 436 |
![]() 一定温度下,向
一定温度下,向![]() 的密闭容器中充入
的密闭容器中充入![]() 发生脱氢反应,经过
发生脱氢反应,经过![]() 达到平衡状态,测得平衡时气体压强是开始的
达到平衡状态,测得平衡时气体压强是开始的![]() 倍。
倍。
![]() 内氢气的生成速率
内氢气的生成速率![]() _______,
_______,![]() 的平衡转化率为_______。
的平衡转化率为_______。
![]() 下列情况能说明该反应达到平衡状态的是____________
下列情况能说明该反应达到平衡状态的是____________![]() 填标号
填标号![]() 。
。
A.混合气体的平均相对分子质量保持不变 ![]() 与
与![]() 的物质的量之比保持不变
的物质的量之比保持不变
C.混合气体的密度保持不变 ![]() 的分解速率与
的分解速率与![]() 的消耗速率相等
的消耗速率相等
![]() 脱氢反应分别在压强为
脱氢反应分别在压强为![]() 和
和![]() 时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示:
时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示:
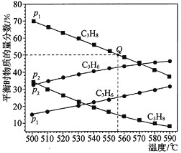
![]() 压强:
压强:![]() _________
_________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 为了同时提高反应速率和反应物的平衡转化率,可采取的措施是___________。
为了同时提高反应速率和反应物的平衡转化率,可采取的措施是___________。
![]() 若
若![]() ,起始时充入丙烷发生反应,则Q点对应温度下,反应的平衡常数
,起始时充入丙烷发生反应,则Q点对应温度下,反应的平衡常数![]() _______
_______![]() 用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。
![]() 实际生产中常在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氧反应,充入氩气的原因是______________。
实际生产中常在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氧反应,充入氩气的原因是______________。