题目内容
8.下列解释事实的方程式不正确的是( )| A. | 测0.01mol/L的醋酸的pH为5:CH3COOH?CH3COO-+H+ | |
| B. | 电解饱和食盐水,产生气体:2Cl-+2H2O$\frac{\underline{\;高温\;}}{\;}$Cl2↑+2OH-+H2↑ | |
| C. | 铁放在氧气中燃烧,产生黑色固体:4Fe+3O 2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | |
| D. | 硫酸钙与碳酸钠溶液,产生白色沉淀:CaSO4(S)+CO32-?CaCO3(S)+SO42- |
分析 A.0.01mol/L的醋酸的pH为5,说明醋酸为弱电解质,部分电离;
B.电极氯化钠溶液生成氢氧化钠和氯气、氢气,反应条件错误;
C.不符合反应的客观事实,铁在氧气中燃烧生成四氧化三铁;
D.碳酸钙溶解度小于硫酸钙,硫酸钙与碳酸钠溶液反应生成碳酸钙和硫酸钠.
解答 解:A.醋酸为弱电解质,电离方程式:CH3COOH?CH3COO-+H+,故A正确;
B.电极氯化钠溶液生成氢氧化钠和氯气、氢气,离子方程式:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+2OH-+H2↑,故B错误;
C.铁放在氧气中燃烧,产生黑色固体四氧化三铁:3Fe+2O 2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4,故C错误;
D.硫酸钙与碳酸钠溶液反应生成碳酸钙和硫酸钠,离子方程式:CaSO4(S)+CO32-?CaCO3(S)+SO42-,故D正确;
故选:BC.
点评 本题考查了化学方程式、离子方程式书写,明确发生的反应是解题关键,注意弱电解质部分电离用可逆号.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.化学与科技、社会、生活密切相关,下列说法不正确的是( )
| A. | 甲醛的水溶液具有杀菌、防腐的作用,可用于保存动物标本 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂或生物柴油 | |
| C. | 在腌制肉类食品时使用较多量的亚硝酸钠,可使食品较长时间保持红润 | |
| D. | 奥运会中采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 |
3.下列离子反应方程式错误的是( )
| A. | 向Na2SiO3溶液中逐滴加入少量稀盐酸:SiO32-+2H+═H2SiO3(胶体) | |
| B. | 稀Fe(NO3)2溶液中加入稀盐酸:Fe2++4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 将Cu片加入稀硝酸中:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 向NH4Al(SO4)2溶液中加入过量的Ba(OH)2稀溶液:NH4++Al3++2SO42-+2Ba2++5OH-═2BaSO4↓+NH3•H2O+AlO2-+2H2O |
13.下列解释事实的方程式正确的是( )
| A. | 向AgCl沉淀中滴入饱和KI溶液反应的离子方程式:AgCl+I-=AgI+Cl- | |
| B. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 向A1C13溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 向Ca(ClO)2溶液中通入适量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
20.NA表示阿伏加德罗常数的值,下列有关说法正确的是( )
| A. | 反应KIO3+6HI=KI+3H2O+3I2,生成3mol I2转移电子的总数为6NA | |
| B. | 标准状况下,由0.4 mol H2O2生成O2转移的电子数目为0.2NA | |
| C. | 12g石墨和C60的混合物中质子总数为6NA | |
| D. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
17.下列有关0.1mol•L-1NaHSO3溶液的叙述正确的是( )
| A. | 该溶液中,K+、NH4+、CH3COOH、S2-可以大量共存 | |
| B. | 和碘水反应的离子方程式:SO32-+I2+H2O=SO42-+2I-+2H+ | |
| C. | 和足量氢氧化钡溶液反应的离子方程式:HSO3-+Ba2++OH-=BaSO3↓+H2O | |
| D. | 1L该溶液和足量稀硝酸充分反应,生成标状况下2.24LSO2 |
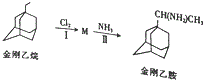 金刚乙烷、金刚乙胺等已经被批准用于临床治疗人感禽流感,且临床研究表明金刚乙烷比金刚乙胺的副作用小.
金刚乙烷、金刚乙胺等已经被批准用于临床治疗人感禽流感,且临床研究表明金刚乙烷比金刚乙胺的副作用小.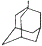 ,如金刚乙烷表示为R-CH2CH3);
,如金刚乙烷表示为R-CH2CH3);
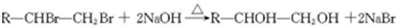 .
.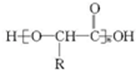 .
.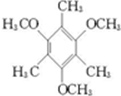 .
.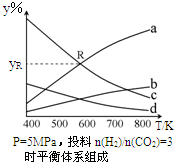 以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示.
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示.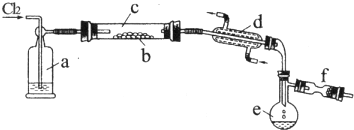
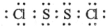 .
.