题目内容
3.下列离子反应方程式错误的是( )| A. | 向Na2SiO3溶液中逐滴加入少量稀盐酸:SiO32-+2H+═H2SiO3(胶体) | |
| B. | 稀Fe(NO3)2溶液中加入稀盐酸:Fe2++4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 将Cu片加入稀硝酸中:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 向NH4Al(SO4)2溶液中加入过量的Ba(OH)2稀溶液:NH4++Al3++2SO42-+2Ba2++5OH-═2BaSO4↓+NH3•H2O+AlO2-+2H2O |
分析 A.硅酸钠与盐酸反应生成硅酸胶体和氯化钠;
B.电荷不守恒;
C.铜与稀硝酸反应生成硝酸铜和一氧化氮和水;
D.氢氧化钡过量反应生成硫酸钡、一水合氨和偏铝酸钡和水.
解答 解:A.硅酸钠与盐酸反应离子方程式:SiO32-+2H+═H2SiO3(胶体),故A正确;
B.稀Fe(NO3)2溶液中加入稀盐酸,离子方程式:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,故B错误;
C.将Cu片加入稀硝酸中反应生成硝酸铜和一氧化氮和水:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故C正确;
D.向NH4Al(SO4)2溶液中加入过量的Ba(OH)2稀溶液,离子方程式:NH4++Al3++2SO42-+2Ba2++5OH-═2BaSO4↓+NH3•H2O+AlO2-+2H2O,故D正确;
故选:B.
点评 本题考查了离子方程式书写,明确反应实质是解题关键,注意反应物用量对反应的影响,选项D为易错选项.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.分子式为C8H8的两种同分异构体X和Y.X是一种芳香烃,分子中只有一个环;Y俗称立方烷,其核磁共振氢谱显示只有一个吸收峰.下列有关说法错误的是( )
| A. | X、Y均能燃烧,都有大量浓烟产生 | |
| B. | X既能使酸性高锰酸钾溶液褪色,也能使溴水褪色,还能发生加聚反应 | |
| C. | Y属于不饱和烃 | |
| D. | Y的二氯代物有三种 |
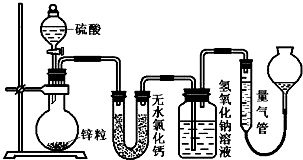
11. 下列选项中的反应、现象与结论完全一致的是(夹持、加热装置已略去)( )
下列选项中的反应、现象与结论完全一致的是(夹持、加热装置已略去)( )
 下列选项中的反应、现象与结论完全一致的是(夹持、加热装置已略去)( )
下列选项中的反应、现象与结论完全一致的是(夹持、加热装置已略去)( )| ①中的反应 | ②中的现象 | 结论 | |
| A | MnO2与浓盐酸加热 | KI淀粉溶液很快变蓝 | Cl2有氧化性 |
| B | Cu与浓硫酸加热 | 溴水褪色 | SO2有漂白性 |
| C | Na2CO3与醋酸溶液 | 苯酚钠溶液变浑浊 | 酸性:碳酸>苯酚 |
| D | 电石与饱和食盐水 | 酸性高锰酸钾溶液褪色 | 乙炔有还原性 |
| A. | A | B. | B | C. | C | D. | D |
18.现有X、Y、Z、M四种短周期元素,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍.下列说法不正确的是( )
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 气态氢化物的稳定性:Z<M | |
| C. | 简单离子半径由大到小的顺序是:Z>M>Y | |
| D. | 等浓度的X2Z与Y2Z的溶液中,水的电离程度:X2Z<Y2Z |
8.下列解释事实的方程式不正确的是( )
| A. | 测0.01mol/L的醋酸的pH为5:CH3COOH?CH3COO-+H+ | |
| B. | 电解饱和食盐水,产生气体:2Cl-+2H2O$\frac{\underline{\;高温\;}}{\;}$Cl2↑+2OH-+H2↑ | |
| C. | 铁放在氧气中燃烧,产生黑色固体:4Fe+3O 2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | |
| D. | 硫酸钙与碳酸钠溶液,产生白色沉淀:CaSO4(S)+CO32-?CaCO3(S)+SO42- |
15.短周期元素X、T、Y、Z、R原子序数依次增大,T最内层电子数为最外层的2倍,部分元素的化合价关系如下表.则下列判断正确的是( )
| X | Y | Z | R | |
| 主要化合价 | -4,+4 | -4,+4 | -2,+6 | -1,+7 |
| A. | 非金属性:Z<R<Y | |
| B. | T与R可以形成化合物:TR2 | |
| C. | X与R的单质均能使品红溶液褪色,且褪色原理相同 | |
| D. | T的最高价氧化物的水化物分别能与X、Y、Z的最高价氧化物反应 |
12.将足量的气体通入下列各溶液中,所含离子或分子还能大量共存的是( )
| A. | 通入足量SO2:Na+、S2-、OH-、AlO2- | B. | 通入足量CO2:K+、Ca2+、Cl-、NO3- | ||
| C. | 通入足量Cl2:SO2、Ba2+、Cl-、K+ | D. | 通入足量NH3:Fe3+、Cl-、Ba2+、Al3+ |
 .
.