题目内容
、I.德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。
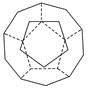
①C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数+棱边数=2,
请回答: C20分子共有________个正五边形,共有________条棱边。
II.A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D元素的核电荷数为29。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为________。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为________,1 mol该分子中含有π键的数目为________。该分子中碳原子的杂化轨道类型是__________________,该分子属于________分子(填“极性”或“非极性”)。
(3)基态D原子的电子排布式为________________。

①C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数+棱边数=2,
请回答: C20分子共有________个正五边形,共有________条棱边。
II.A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D元素的核电荷数为29。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为________。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为________,1 mol该分子中含有π键的数目为________。该分子中碳原子的杂化轨道类型是__________________,该分子属于________分子(填“极性”或“非极性”)。
(3)基态D原子的电子排布式为________________。
I.12 30
II. (1)C<O<N
(2)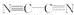 4NA(或2.408×1024) sp 非极性
4NA(或2.408×1024) sp 非极性
(3)1s22s22p63s23p63d104s1
II. (1)C<O<N
(2)
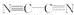 4NA(或2.408×1024) sp 非极性
4NA(或2.408×1024) sp 非极性(3)1s22s22p63s23p63d104s1
I.顶点数为20、棱数为20×3÷2=30、面数=30+2-20=12。
II.由题意可知,A、B、C、D四种元素分别是C、N、O、Cu,(1)注意,第一电离能N>O。
(2)(AB)2中键与键之间的夹角为180°,说明该分子为对称直线型非极性分子。(3)Cu的前三层是全充满状态,前三层占有28个电子。
II.由题意可知,A、B、C、D四种元素分别是C、N、O、Cu,(1)注意,第一电离能N>O。
(2)(AB)2中键与键之间的夹角为180°,说明该分子为对称直线型非极性分子。(3)Cu的前三层是全充满状态,前三层占有28个电子。

练习册系列答案
相关题目
 Rn(氡),会对人体产生一定危害。该原子的中子数和质子数之差是
Rn(氡),会对人体产生一定危害。该原子的中子数和质子数之差是
 ,每个晶胞中分摊2个钾原子
,每个晶胞中分摊2个钾原子 Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。
