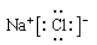题目内容
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A、B与C;D、E与F分别位于同一周期。A原子L层上有3个未成对电子,B的简单负二价离子与C原子核外电子排布相同、含有D元素的盐的焰色反应火焰为黄色,EF3是由活泼金属和活泼非金属组成的共价化合物,G有多种氧化物,其中一种氧化物有磁性,填写下列空白
(1)元素的第一电离能最大的是________,属于过渡元素的是________(填写元素符号)
(2)写出B元素的基态原子价电子排布式__________________,F离子电子排布式_________________。
(3)AF3分子中A原子的杂化类型是________,AF3分子的几何构型为___________。
(4)已知E2B3的晶格比DF的晶格能大得多,试分析导致两者晶格能差异的主要原因是:________________________________________________________。
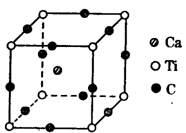
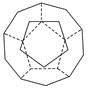
(5)构成G晶体的微粒是________,G的晶胞结构如下图甲所示,G的晶胞为________结构。若G原子的半径为1.27×10-10 m,G金属晶体中的晶胞长度,即下图乙中AB的长度为________m。

(1)元素的第一电离能最大的是________,属于过渡元素的是________(填写元素符号)
(2)写出B元素的基态原子价电子排布式__________________,F离子电子排布式_________________。
(3)AF3分子中A原子的杂化类型是________,AF3分子的几何构型为___________。
(4)已知E2B3的晶格比DF的晶格能大得多,试分析导致两者晶格能差异的主要原因是:________________________________________________________。
(5)构成G晶体的微粒是________,G的晶胞结构如下图甲所示,G的晶胞为________结构。若G原子的半径为1.27×10-10 m,G金属晶体中的晶胞长度,即下图乙中AB的长度为________m。

(1)Ne Fe
(2)2s22p4 1s22s22p63s23p6
(3)sp3 三角锥形
(4)Al2O3晶体中Al3+、O2-的带电荷大于NaCl晶体中Na+、Cl-的带电荷
(5)金属阳离子、自由电子 面心立方 3.59×10-10
(2)2s22p4 1s22s22p63s23p6
(3)sp3 三角锥形
(4)Al2O3晶体中Al3+、O2-的带电荷大于NaCl晶体中Na+、Cl-的带电荷
(5)金属阳离子、自由电子 面心立方 3.59×10-10
由题干知道,这几种元素分别是A(氮)、B(氧)、C(氖)、D(钠)、E(铝)、F(氯)、G(铁)。
(1)氖原子是最外层为8电子稳定结构,不易失去电子,所以氖的第一电离能最大。
(2)O元素的基态原子价电子排布式是2s22p4;Cl-的电子排布式是1s22s22p63s23p6;
(3)NCl3中N采取sp3杂化,其中一个杂化轨道上有一对电子,不参与成键,另外三个杂化轨道分别与三个Cl形成σ键,由于一对孤对电子的存在,三个Cl不可能平均瓜分N周围的空间,而是被孤对电子排斥到一侧,形成三角锥形结构。
(4)Al2O3晶体的晶格能大于NaCl晶体的晶格能的主要原因是Al2O3晶体中Al3+、O2-的电荷大于NaCl晶体中Na+、Cl-的电荷;次要原因是离子半径。
(5) AB2+BC2=AC2且AB=BC
AB2=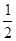 ×(4×1.27×10-10)2
×(4×1.27×10-10)2
AB=3.59×10-10
(1)氖原子是最外层为8电子稳定结构,不易失去电子,所以氖的第一电离能最大。
(2)O元素的基态原子价电子排布式是2s22p4;Cl-的电子排布式是1s22s22p63s23p6;
(3)NCl3中N采取sp3杂化,其中一个杂化轨道上有一对电子,不参与成键,另外三个杂化轨道分别与三个Cl形成σ键,由于一对孤对电子的存在,三个Cl不可能平均瓜分N周围的空间,而是被孤对电子排斥到一侧,形成三角锥形结构。
(4)Al2O3晶体的晶格能大于NaCl晶体的晶格能的主要原因是Al2O3晶体中Al3+、O2-的电荷大于NaCl晶体中Na+、Cl-的电荷;次要原因是离子半径。
(5) AB2+BC2=AC2且AB=BC
AB2=
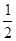 ×(4×1.27×10-10)2
×(4×1.27×10-10)2AB=3.59×10-10

练习册系列答案
相关题目
 ”或“
”或“ ”)。
”)。