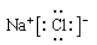题目内容
【物质结构与性质】
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。
(1)基态E原子的价电子排布式为 ;
(2)AB32-的立体构型是 ,其中A原子的杂化轨道类型是 。
(3)A22-与B22+互为等电子体,B22+的电子式可表示为 ,1mol B22+中含有的π键数目为 。
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键 。
(5)化合物DC2的晶胞结构如图所示,该离子化合协晶体的密度为a g/cm3,则晶胞的体积是 (只要求列算式,阿伏加德罗常数的值为NA)

已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。
(1)基态E原子的价电子排布式为 ;
(2)AB32-的立体构型是 ,其中A原子的杂化轨道类型是 。
(3)A22-与B22+互为等电子体,B22+的电子式可表示为 ,1mol B22+中含有的π键数目为 。
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键 。
(5)化合物DC2的晶胞结构如图所示,该离子化合协晶体的密度为a g/cm3,则晶胞的体积是 (只要求列算式,阿伏加德罗常数的值为NA)

(1)3d54s1
(2)平面三角形 sp2
(3)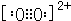 2NA
2NA
(4)F-H…F、F-H…O、O-H…F、O-H…O
(5)312/aNA cm3
(2)平面三角形 sp2
(3)
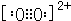 2NA
2NA(4)F-H…F、F-H…O、O-H…F、O-H…O
(5)312/aNA cm3
A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,则A原子有2个电子层,最外层电子数为4,故A为碳元素;C在元素周期表的各元素中电负性最大,则C为氟元素;B原子基态时s电子数与P电子数相等,原子序数小于氟元素,处于第二周期,核外电子排布为1s22s22p4,则B为氧元素;D的基态原子核外有6个能级且全部充满电子,核外电子排布为1s22s22p63s23p64s2,则D为Ca元素;
E原子基态时未成对电子数是同周期元素中最多的,其原子外围电子排布为3d54s1,则E为Cr元素。
(1)E为Cr元素,基态原子的价电子排布式为3d54s1
(2)CO32-中C原子的价层电子对数为3+(4+2?2×3)/2=3,C原子孤对电子对数=(4+2?2×3)/2=0,CO32-为平面三角形,C原子采取sp2杂化
(3)C22-与O22+互为等电子体,离子结构相同,O22+的电子式可表示为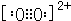 ,1mol O22+中含有的π键数目为2NA
,1mol O22+中含有的π键数目为2NA
(4)HF水溶液中存在的所有氢键为:F-H…F、F-H…O、O-H…F、O-H…O
(5)由化合物CaF2的晶胞结构可知,晶胞中含有钙离子数目为8×1/8++6×1/2=4
含有氟离子数目为8,故晶胞的质量为4×78g,该离子化合协晶体的密度为a g/cm3,则晶胞的体积=4×78/NA/ a g/cm3="312" /aNA cm3
E原子基态时未成对电子数是同周期元素中最多的,其原子外围电子排布为3d54s1,则E为Cr元素。
(1)E为Cr元素,基态原子的价电子排布式为3d54s1
(2)CO32-中C原子的价层电子对数为3+(4+2?2×3)/2=3,C原子孤对电子对数=(4+2?2×3)/2=0,CO32-为平面三角形,C原子采取sp2杂化
(3)C22-与O22+互为等电子体,离子结构相同,O22+的电子式可表示为
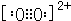 ,1mol O22+中含有的π键数目为2NA
,1mol O22+中含有的π键数目为2NA(4)HF水溶液中存在的所有氢键为:F-H…F、F-H…O、O-H…F、O-H…O
(5)由化合物CaF2的晶胞结构可知,晶胞中含有钙离子数目为8×1/8++6×1/2=4
含有氟离子数目为8,故晶胞的质量为4×78g,该离子化合协晶体的密度为a g/cm3,则晶胞的体积=4×78/NA/ a g/cm3="312" /aNA cm3

练习册系列答案
相关题目
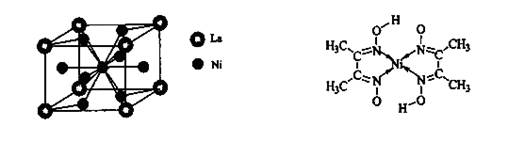
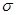 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;