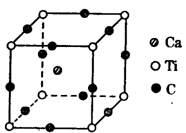
题目内容
(15分)铜是过渡金属元素,可以形成多种化合物。
(1)CuCl的盐酸溶液能够与CO发生反应:CuCl+CO+H2O=Cu(CO)Cl·H2O
①电负性:C ______O(填“>”或“=”或“<”)。②CO常温下为气体,固态时属于 晶体。
(2)Cu+与NH3形成的配合物可表示成[Cu(NH3)n]+,该配合物中,Cu+的4s轨道及4p通过sp杂化接受NH3提供的电子对。 [Cu(NH3) n]+中Cu+与n个氮原子的空间结构呈 型,n= 。
(3)CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):

请回答下列问题:
①该配离子[Cu(En)2]2+中的中心原子的基态外围电子排布式为 。
②乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
③该配离子[Cu(En)2]2+中存在的作用力类型有 (填字母);
A配位键 B极性键 C离子键
D非极性键 E.氢键 F.金属键
(1)CuCl的盐酸溶液能够与CO发生反应:CuCl+CO+H2O=Cu(CO)Cl·H2O
①电负性:C ______O(填“>”或“=”或“<”)。②CO常温下为气体,固态时属于 晶体。
(2)Cu+与NH3形成的配合物可表示成[Cu(NH3)n]+,该配合物中,Cu+的4s轨道及4p通过sp杂化接受NH3提供的电子对。 [Cu(NH3) n]+中Cu+与n个氮原子的空间结构呈 型,n= 。
(3)CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):

请回答下列问题:
①该配离子[Cu(En)2]2+中的中心原子的基态外围电子排布式为 。
②乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
③该配离子[Cu(En)2]2+中存在的作用力类型有 (填字母);
A配位键 B极性键 C离子键
D非极性键 E.氢键 F.金属键
(1)① < ② 分子 (2)直线形 2
(3)①3d9 ②sp3杂化 乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键 ③ABD
(3)①3d9 ②sp3杂化 乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键 ③ABD
试题分析:(1)①由于原子的比较C>O,元素的非金属性C<O。所以电负性:C<O。②CO常温下为气体,分子与分子之间通过分子间作用力结合形成分子晶体。因此在固态时属于分子晶体。(2)①在Cu+的4s轨道及4p通过sp杂化,是直线型的,所以[Cu(NH3) n]+中Cu+与n个氮原子的空间结构呈直线形,n=2。(3)①该配离子[Cu(En)2]2+中的中心原子Cu的基态外围电子排布式为3d9; ②乙二胺分子中氮原子轨道的杂化类型为sp3杂化;乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键.增加了分子之间的相互作用,使物质气化消耗的分子间作用力大,需要的能量高,所以沸点高。③该配离子[Cu(En)2]2+中存在的作用力类型有A.N与Cu之间的配位键;B.N与H之间的极性键、C与H之间的极性键;D.C与C之间的非极性键。因此选项为A、B、D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
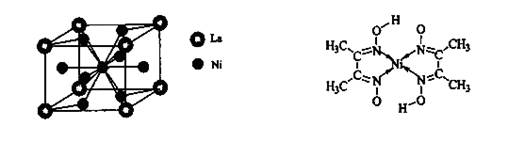
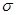 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;


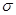 ”或“
”或“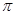 ”)。
”)。