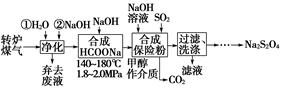
题目内容
水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前,_______ 和_______是主要的去离子方法。
(2)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。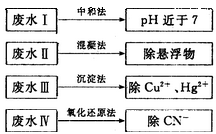
①废水I若采用CO2处理,离子方程式是_______。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO3-)越大,净水效果越好,这是因为________。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++_______=CH3Hg++H+。我国规定,Hg2+的排放标准不能超过0. 05 mg/L。若某工厂排放的废水1L中含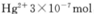 ,是否达到了排放标准_______(填“是”或“否”)。
,是否达到了排放标准_______(填“是”或“否”)。
④废水Ⅳ常用Cl2氧化CN-成CO2和N2。,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为____________
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行________处理。把进行过离子交换的CaR2(或MgR2)型树脂置于_______中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,如图是海水中利用电渗析法获得淡水的原理图,已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请回答: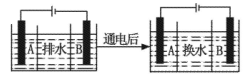
①阳离子交换膜是指____(填“A”或“B”)。②写出通电后阳极区的电极反应式____。
(1)离子交换法 膜分离法;
(2)①OH-+CO2=HCO3-②HCO3-会促进Al3+的水解,生成更多的Al(OH)3,净水效果增强 ③CH4否 ④5Cl2+2CN-+4H2O=10Cl-+2CO2+N2+8H+
(3)软化 食盐水;
(4)①B ②2Cl-—2e-=Cl2↑
解析试题分析:(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前离子交换法和膜分离法是主要的去离子方法。(2)①废水I的处理方法是中和法,由于CO2水溶液显酸性,所以该方法就是去除OH-。处理的离子方程式为:OH-+CO2=HCO3-。②废水Ⅱ的处理方法是悬凝法,是用来使悬浮的固体小颗粒沉降。常用明矾作净水剂。在实践中发现废水中的c(HCO3-)越大,净水效果越好,这是因为Al3+和HCO3- 发生双水解反应Al3++3HCO3-= Al(OH)3↓+3CO2↑,会促进Al3+的水解。水解的程度越大,产生的Al(OH)3就越多,吸附效果就越好,因而净水效果增强。③废水III中的汞元素存在如下转化(在空格上填相应的化学式)根据质量守恒定律可得缺少的物质应该为CH4。在1L的废水中含有的Hg2+的质量为3×10-7mol × 201g/mol=6.02×10-5g=6.02×10-2mg>0. 05 mg.因此不符合排放标准。④废水Ⅳ常用Cl2氧化CN-成CO2和N2。,若参加反应的Cl2与CN-的物质的量之比为5:2,根据质量守恒定律及电荷守恒可得该反应的离子方程式为5Cl2+2CN-+4H2O=10Cl-+2CO2+N2+8H+。(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行软化处理,以降低Ca2+、Mg2+的含量。把进行过离子交换的CaR2(或MgR2)型树脂置于NaCl溶液中浸泡,发生反应:CaR2+2NaCl=2NaR+CaCl2或MgR2+2NaCl=2NaR+MgCl2一段时间后便得到了NaR,又能重复使用。即获得了再生。(4)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜B和阴极相连,电解池阴极是阳离子放电,所以隔膜B是阳离子交换膜。②电解池阳极是溶液中的氯离子放电,所以通电后阳极电极反应式是2Cl――2e-=Cl2↑。
考点:考查水的净化、污水处理、硬水软化、氧化还原反应的有关判断以及电极反应式的书写等知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去。某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响。该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02 mol·L-1、0.002 mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.2 mol·L-1、0.4 mol·L-1;
③每次实验时KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成____ 组实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如下表所示:
| KMnO4酸性溶液浓度 (mol·L-1) | 溶液褪色所需时间(min) | | ||
| 第一次 | 第二次 | 第三次 | ||
| 0.02 | 14 | 13 | 11 | |
| 0.002 | 6.7 | 6.6 | 6.7 | |
①用0.002 mol/L KMnO4酸性溶液进行实验时,KMnO4的平均反应速率(忽略混合前后溶液体积变化)。
②依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论。某同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论。
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/ mol/L | 体积(ml) | 浓度/ mol/L | 体积(ml) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
则表中a= ;b= ;c= 。
(3)草酸电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5。与KMnO4反应时,它将转化为CO2和H2O。
①草酸与酸性高锰酸钾溶液反应的离子方程式为 。
②室温下,0.1mol·L-1 KHC2O4酸溶液中pH 7,理由是 。
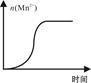
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因: 。
 Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。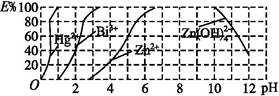
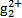 )必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H
)必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2