题目内容
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去。某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响。该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02 mol·L-1、0.002 mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.2 mol·L-1、0.4 mol·L-1;
③每次实验时KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成____ 组实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如下表所示:
| KMnO4酸性溶液浓度 (mol·L-1) | 溶液褪色所需时间(min) | | ||
| 第一次 | 第二次 | 第三次 | ||
| 0.02 | 14 | 13 | 11 | |
| 0.002 | 6.7 | 6.6 | 6.7 | |
①用0.002 mol/L KMnO4酸性溶液进行实验时,KMnO4的平均反应速率(忽略混合前后溶液体积变化)。
②依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论。某同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论。
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/ mol/L | 体积(ml) | 浓度/ mol/L | 体积(ml) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
则表中a= ;b= ;c= 。
(3)草酸电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5。与KMnO4反应时,它将转化为CO2和H2O。
①草酸与酸性高锰酸钾溶液反应的离子方程式为 。
②室温下,0.1mol·L-1 KHC2O4酸溶液中pH 7,理由是 。
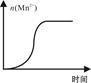
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因: 。
(1)4;
(2)①2×10-4mol/(L·min)
②0.02 0.2或0.4 0.4或0.2
(3)①5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
②< 因为HC2O4-的电离程度大于HC2O4-的水解程度
(4)Mn2+对该反应有催化作用
解析试题分析:(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,首先要在一定温度下,用一种浓度的KMnO4酸性溶液和H2C2O4进行实验作对照。然后通过改变KMnO4或H2C2O4的浓度来关系反应的快慢以测定浓度对反应速率的影响;再进行其它的条件不变,通过改变反应温度来测定反应速率,来实现温度对反应速率的影响;最后进行其它条件不变,加入催化剂来观察反应速率的快慢实现催化剂对反应速率的影响的实验。因此至少需要完成4组实验进行对比即可得出结论。(2)①用0.002 mol/L KMnO4酸性溶液进行实验时,Δt=(6.7+6.6+6.7)÷3=20/3min.v(KMnO4)=Δc÷Δt ="0.002" mol/L×4÷(4+2) ÷20/3min=2×10-4mol/(L·min)。②若要得出“褪色时间越短,反应的速率越快”结论应该只改变一个量,其它都相同,观察褪色时间的长短。a=0.02;b=0.2,c=0.4或a=0.02;b=0.4,c=0.2.(3)①由电离平衡常数可知草酸是弱酸。因此根据氧化反应反应的规律及离子方程式的拆写原则可得:草酸与酸性高锰酸钾溶液反应的离子方程式为5H2C2O4+2MnO4-+6H+= 2Mn2++ 10CO2↑+8H2O。②室温下,草酸电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5可知草酸氢根离子的电离作用大于其水解作用,所以溶液呈酸性。pH<7.(4)n(Mn2+)在反应起始时变化不大,速率也变化不大,一段时间后由于n(Mn2+)增多,反应速率快速增大是因为Mn2+对该反应有催化作用。
考点:考查实验方案的设计、离子方程式的书写、多元弱酸的酸式盐的电离与水解及溶液的酸碱性的知识。

二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是________。
| A.只有还原性 | B.还原性和酸性 |
| C.只有氧化性 | D.氧化性和酸性 |
(2)目前已开发出用电解法制取ClO2的新工艺。
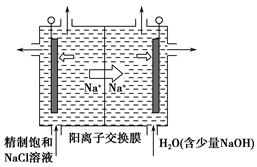
①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生ClO2的电极反应式为_____________________________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol,用平衡移动原理解释阴极区pH增大的原因:______________________________________。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN-a mg/L,现用ClO2将CN-氧化,产物中有两种气体生成,其离子反应方程式为________________;处理100 m3这种污水,至少需要ClO2________mol。
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-=5I-+IO3-+3H2O
KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是 (用化学式表示);CCl4中显紫红色的物质是 (用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式: 。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由: 。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是 。
| A.Na2S2O3 | B.AlCl3 |
| C.Na2CO3 | D.NaNO2 |
 溶液,当Al3+恰好全部沉淀时:
溶液,当Al3+恰好全部沉淀时: 
 (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol· +5Fe3+ +2H2O 14H+ +
+5Fe3+ +2H2O 14H+ + +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O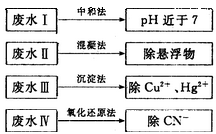
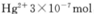 ,是否达到了排放标准_______(填“是”或“否”)。
,是否达到了排放标准_______(填“是”或“否”)。