题目内容
5.以氯乙烷为主要原料经过三步反应合成乙二醇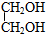 ,写出有关反应的化学方程式.CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O;CH2=CH2+Cl2→CH2Cl-CH2Cl;CH2Cl-CH2Cl+2NaOH $→_{△}^{水}$HOCH2CH2OH+2NaCl.
,写出有关反应的化学方程式.CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O;CH2=CH2+Cl2→CH2Cl-CH2Cl;CH2Cl-CH2Cl+2NaOH $→_{△}^{水}$HOCH2CH2OH+2NaCl.
分析 CH3CH2Cl在氢氧化钠醇溶液、加热条件下发生消去反应生成CH2=CH2,乙烯与氯气发生加成反应生成1,2-二氯乙烷,1-2二氯乙烷在氢氧化钠水溶液、加热条件下发生水解反应生成乙二醇,据此解答.
解答 解:CH3CH2Cl在氢氧化钠醇溶液、加热条件下发生消去反应生成CH2=CH2,反应方程式为CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O,乙烯与氯气发生加成反应生成1,2-二氯乙烷,反应方程式为CH2=CH2+Cl2→CH2Cl-CH2Cl,1-2二氯乙烷在氢氧化钠水溶液、加热条件下发生水解反应生成乙二醇,反应方程式为
CH2Cl-CH2Cl+2NaOH $→_{△}^{水}$HOCH2CH2OH+2NaCl;
故答案为:CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O;CH2=CH2+Cl2→CH2Cl-CH2Cl;CH2Cl-CH2Cl+2NaOH $→_{△}^{水}$HOCH2CH2OH+2NaCl.
点评 本题考查了有机物的合成,明确氯代烃的性质是解题关键注意氯代烃消去、水解反应的条件的不同,题目难度不大.

练习册系列答案
相关题目
15.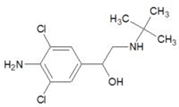 2011年3 月17日《京华时报》报道,双汇集团就“瘦肉精”事件致谦,涉事子公司停产整顿.盐酸克伦特罗(clenbuteerol CLB),俗名“瘦肉精”. 其结构如图所示,下列有关“瘦肉精”的说法中正确的是( )
2011年3 月17日《京华时报》报道,双汇集团就“瘦肉精”事件致谦,涉事子公司停产整顿.盐酸克伦特罗(clenbuteerol CLB),俗名“瘦肉精”. 其结构如图所示,下列有关“瘦肉精”的说法中正确的是( )
 2011年3 月17日《京华时报》报道,双汇集团就“瘦肉精”事件致谦,涉事子公司停产整顿.盐酸克伦特罗(clenbuteerol CLB),俗名“瘦肉精”. 其结构如图所示,下列有关“瘦肉精”的说法中正确的是( )
2011年3 月17日《京华时报》报道,双汇集团就“瘦肉精”事件致谦,涉事子公司停产整顿.盐酸克伦特罗(clenbuteerol CLB),俗名“瘦肉精”. 其结构如图所示,下列有关“瘦肉精”的说法中正确的是( )| A. | 该分子是极性分子 | |
| B. | 该分子中有两个手性碳 | |
| C. | 分子中C、N、O的第一电离能的大小顺序为:C<N<O | |
| D. | 苯环上的一溴代物只有一种结构 |
16.下列各种有机物能发生加成、加聚、酯化、水解、中和反应的是( )
| A. |  | B. |  | C. | HCOOCH=CHCOOH | D. | CH2=C-COOCH3 |
13.下列四种元素中,其单质的氧化性最强的是( )
| A. | 基态原子含有未成对电子最多的第二周期元素 | |
| B. | 某激发态为1s22s12p3的原子 | |
| C. | 基态原子最外层电子排布为2s22p6的元素 | |
| D. | 基态原子最外层电子排布为3s23p5的元素 |
10.下列说法正确的是(NA为阿伏加德罗常数)( )
| A. | 124 g P4含有P-P键的个数为4NA | |
| B. | 12 g石墨中含有C-C键的个数为1.5NA | |
| C. | 12 g金刚石中含有C-C键的个数为4NA | |
| D. | 60gSiO2中含Si-O键的个数为2NA |
14.在0.1mol•L-1氨水中加入少量的氯化铵晶体,则NH3•H2O的电离常数( )
| A. | 变大 | B. | 变小 | C. | 不变 | D. | 无法确定 |