题目内容
14.在0.1mol•L-1氨水中加入少量的氯化铵晶体,则NH3•H2O的电离常数( )| A. | 变大 | B. | 变小 | C. | 不变 | D. | 无法确定 |
分析 弱电解质的电离平衡常数只与温度有关,溶液的温度不变,则电离平衡常数不变,据此进行判断.
解答 解:在0.1mol•L-1氨水中加入少量的氯化铵晶体,溶液中铵根离子浓度增大,一水合氨的电离程度减小,由于温度不变,则一水合氨的电离平衡常数不变,
故选C.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度不大,明确电离平衡常数只受温度影响,与溶液浓度大小无关为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列物质既能够与强酸又能够与强碱反应,且反应后都能产生气体的是( )
| A. | 硫化铵 | B. | 亚硫酸氢钾 | C. | 碳酸氢钠 | D. | 硫酸氢铵 |
2.漂白粉的有效成分是( )
| A. | NaOH | B. | Ca(ClO)2 | C. | NaCl | D. | Na2O2 |
19.下列说法正确的是( )
| A. | 共价化合物中不可能含有离子键 | |
| B. | 只有金属元素和非金属元素才能形成离子键 | |
| C. | 水分子很稳定,因为水分子间存在氢键 | |
| D. | 所有的分子晶体内都存在两种以上作用力 |
6.将100mL 3mol•L-1的NaOH溶液与100mL 3mol•L-1的AlCl3溶液按下列两种方法混合:
(1)将NaOH溶液逐滴入AlCl3溶液中;
(2)将AlCl3溶液逐滴滴入NaOH溶液中,对上述实验所得结论正确的是( )
(1)将NaOH溶液逐滴入AlCl3溶液中;
(2)将AlCl3溶液逐滴滴入NaOH溶液中,对上述实验所得结论正确的是( )
| A. | 现象相同,沉淀量相等 | B. | 现象相同,沉淀量不等 | ||
| C. | 现象不同,沉淀量相等 | D. | 现象不同,沉淀量不等 |
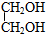 ,写出有关反应的化学方程式.CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O;CH2=CH2+Cl2→CH2Cl-CH2Cl;CH2Cl-CH2Cl+2NaOH $→_{△}^{水}$HOCH2CH2OH+2NaCl.
,写出有关反应的化学方程式.CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O;CH2=CH2+Cl2→CH2Cl-CH2Cl;CH2Cl-CH2Cl+2NaOH $→_{△}^{水}$HOCH2CH2OH+2NaCl.
 CH3COOCH2CH3+H2O,该反应类型为酯化反应(取代反应).
CH3COOCH2CH3+H2O,该反应类型为酯化反应(取代反应). CO(g)+H2(
CO(g)+H2( g)△H>0,达到平衡时,下列说法正确的是( )
g)△H>0,达到平衡时,下列说法正确的是( )