题目内容
13.下列四种元素中,其单质的氧化性最强的是( )| A. | 基态原子含有未成对电子最多的第二周期元素 | |
| B. | 某激发态为1s22s12p3的原子 | |
| C. | 基态原子最外层电子排布为2s22p6的元素 | |
| D. | 基态原子最外层电子排布为3s23p5的元素 |
分析 根据原子结构判断各选项中元素,根据结构特点与非金属性判断,非金属性越强,单质的氧化性越强.
解答 解:A.原子含未成对电子最多的第二周期元素是N元素,氮气分子中含有三键,氮气的化学性质稳定;
B.激发态为1s22s12p3的原子,属于碳元素;
C.基态原子最外层电子排布为2s22p6的元素是Ne元素,最外层电子数为8,化学性质稳定;
D.原子最外层电子排布为3s23p5的元素是Cl元素,
非金属性Cl>N>C,氯气的氧化性最强,
故选D.
点评 本题考查结构位置以性质关系,比较基础,注意基础知识的掌握,注意把握单质氧化性的判断方法.

练习册系列答案
相关题目
3.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,总反应式为:2C2H6+7O2+8KOH═4K2CO3+10H2O,下列推断正确的是( )
| A. | 负极反应为7O2+14 H2O+28e-→28OH- | |
| B. | 每消耗1molC2H6,则电路上转移的电子为14mol | |
| C. | 放电一段时间后,负极周围的pH升高 | |
| D. | 放电过程中KOH的物质的量浓度减小 |
4.下列物质既能够与强酸又能够与强碱反应,且反应后都能产生气体的是( )
| A. | 硫化铵 | B. | 亚硫酸氢钾 | C. | 碳酸氢钠 | D. | 硫酸氢铵 |
1.下列说法中,正确的是( )
| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | △H>0 kJ•mol-1表示放热反应,△H<0 kJ•mol-1表示吸热反应 | |
| C. | 1 mol H2SO4与1 molBa(OH)2反应生成H2O时放出的热叫做中和热 | |
| D. | 1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热 |
8.利用电负性数值可以预测( )
| A. | 分子的极性 | B. | 分子的对称性 | C. | 分子的空间构型 | D. | 化学键的极性 |
18.某有机化合物的结构简式如图所示,下列叙述不正确的是( )


| A. | 它有酸性,能与纯碱溶液反应 | |
| B. | 它在一定条件下能发生水解,且产物只有一种 | |
| C. | 1 mol该有机物最多能与7 mol NaOH反应 | |
| D. | 1 mol该有机物最多能与4 mol Br2反应 |
2.漂白粉的有效成分是( )
| A. | NaOH | B. | Ca(ClO)2 | C. | NaCl | D. | Na2O2 |
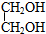 ,写出有关反应的化学方程式.CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O;CH2=CH2+Cl2→CH2Cl-CH2Cl;CH2Cl-CH2Cl+2NaOH $→_{△}^{水}$HOCH2CH2OH+2NaCl.
,写出有关反应的化学方程式.CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O;CH2=CH2+Cl2→CH2Cl-CH2Cl;CH2Cl-CH2Cl+2NaOH $→_{△}^{水}$HOCH2CH2OH+2NaCl. CO(g)+H2(
CO(g)+H2( g)△H>0,达到平衡时,下列说法正确的是( )
g)△H>0,达到平衡时,下列说法正确的是( )