��Ŀ����
����Ŀ��ij��ѧ��ȤѧϰС�����ʵ��̽������M��Ũ���ᷴӦ��������
[�������]����1���������ֻ��SO2������2��_______________��
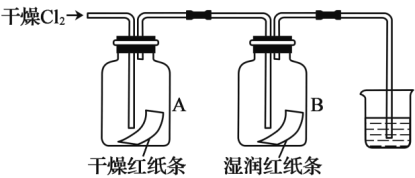
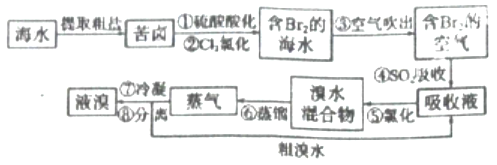
[ʵ�����]Ϊ��̽������M��Ũ���ᷴӦ��������ͼʵ��װ�ã�һ������Ũ���������M��Ӧ��
��1�� �������װ�������Ե�һ�ַ����ǣ��رշ�Һ©���Ļ�������Hװ�ú�������һ�����ܣ�Ȼ��_________________________����֤��װ�õ����������á�
��2����Bƿ��Ʒ����Һ��ɫ��E��F��G�ж�����������Ӧ���������н����ԣ�2�ۡ�дA�з�����Ӧ�Ļ�ѧ����ʽ��______________________��
��3��������2��ȷ����ɹ۲쵽��F����_____________��G�������______________��
[ʵ�鷴˼] Ϊ�˽�һ��̽������M�ɷֺ�������֣���������ʵ�飺
��ȡ11��2g����M����װ��A�У�����һ������Ũ���ᣬ��Ӧ������Bƿ��Ʒ����Һ��ɫ������û��ʣ�࣬����G�����أ�G����0��9g��
��4��Ϊ�˹۲���Һ��ɫ��ʵ����Ϻ���Ҫϡ����ƿ����Һ��ϡ����ƿ����Һ�IJ���������________��
��5����ϡ�ͺ����Һ��װ�ס����Թܣ�����Թ���μ�KSCN��Һ����Һ���ɫ�������Թ���μ����Ը��������Һ������Һ��ɫ��ȥ�������ƿ��Һ�н�������Ũ����ȣ�������ɷּ����ʵ���Ϊ__________����д����ƿ�����Ӧ���ܻ�ѧ����ʽ____________________��
���𰸡�����2�����������SO2��H2 �������ܲ���ʢ��ˮ��ˮ���У�����ƿ����������ð���ݣ�ֹͣ������һ��ˮ�������� M��2H2SO4��Ũ��![]() MSO4��SO2����2H2O ��ɫ��ĩ��ɺ�ɫ ��ɫ��ĩ��Ϊ��ɫ �Ƚ���ƿ�л����Һ��ȴ���ٽ����Һ��������ʢˮ���ձ�������Ͻ��� SO2��0��20mol ��H2��0��05mol 4Fe��9H2SO4(Ũ)
MSO4��SO2����2H2O ��ɫ��ĩ��ɺ�ɫ ��ɫ��ĩ��Ϊ��ɫ �Ƚ���ƿ�л����Һ��ȴ���ٽ����Һ��������ʢˮ���ձ�������Ͻ��� SO2��0��20mol ��H2��0��05mol 4Fe��9H2SO4(Ũ) ![]() 2FeSO4��Fe2(SO4)3��4SO2����H2����8H2O
2FeSO4��Fe2(SO4)3��4SO2����H2����8H2O
��������
����������ʱ���ҽ����ϻ��ã������ɵ������п��ܺ������������Լ���2Ϊ�����������SO2��H2��
��1���������װ�������Ե�һ�ַ����ǣ��رշ�Һ©���Ļ�������Hװ�ú�������һ�����ܣ�Ȼ�����ܲ���ʢ��ˮ��ˮ���У�����ƿ����������ð���ݣ�ֹͣ������һ��ˮ����������˵��װ�õ����������á�
��2����Ӧ���������н�����+2�ۣ����ͭ��Ũ����ķ�Ӧ��M��Ũ���ᷴӦ�Ļ�ѧ����ʽΪ��M��2H2SO4(Ũ)![]() MSO4��SO2����2H2O��
MSO4��SO2����2H2O��
��3�����F���к�ɫ��ĩ��ɺ�ɫ��G�а�ɫ����ˮ����ͭ�����ɫ��˵�����������л����������Ӷ�֤������2��ȷ��
��4��Ũ��������ˮ���ȣ���Ũ������ܶȴ���ˮ����˿������ϡ��Ũ����ķ������в���������Ϊ���Ƚ���ƿ�л����Һ��ȴ���ٽ����Һ��������ʢˮ���ձ�������Ͻ��衣
��5������Թ���μ�KSCN��Һ����Һ���ɫ��˵������MΪFe��G����0.9g��0.9gΪˮ�������������������ʵ���Ϊ��n��H2��=n��H2O��=0.9g��18g/mol��0.05mol��1.2g�������ʵ���Ϊ��n(Fe)="11.2g��56g/mol=" 0.2mol�������Թ���μ����Ը��������Һ������Һ��ɫ��ȥ��˵����Һ�к����������ӣ���ƿ��Һ�н�������Ũ����ȣ��������Ӻ��������ӵ����ʵ�����ȣ�n��Fe2+��=n��Fe3+��=0.1mol�����ݵ����غ㣬���ɶ�����������ʵ���Ϊ��n��SO2��=![]() mol��0.20mol������������ᷴӦ�Ļ�ѧ����ʽΪ��4Fe��9H2SO4��Ũ��
mol��0.20mol������������ᷴӦ�Ļ�ѧ����ʽΪ��4Fe��9H2SO4��Ũ��![]() 2FeSO4��Fe2(SO4)3��4SO2����H2����8H2O��
2FeSO4��Fe2(SO4)3��4SO2����H2����8H2O��
�����硿
�������ۺ���ʵ���⣬�ѶȽϴ������й����ʵĻ�ѧ���ʺ�ʵ��ԭ���ǹؼ����ٽ����йؼ���ʱ��Ҫ�����ڸ����غ㷨���������װ�������Լ�����Ҫע�⣺���װ�������Ե�ԭ��һ�㶼��ͨ���ı�װ��������ѹǿʵ�ֵģ�����������Ե�װ�ñ�����һ����������װ�ã����һ��Ҫ������һ���ܱ���ϵ��װ�������Եļ�飬�����������㣺һ�Ƿ������������ֱ�������������ʽ�ǣ�װ���γɷ����ϵ������(�ȡ����桢��ë���桢��ˮ��)�������������ó����ۣ����ȷ����Ĺؼ����Ƿ�ա��ȡ����ݡ�ˮ������Һ��(��)���Ĺؼ����Ƿ�ա�Һ�