题目内容
【题目】氯气是一种具有重要用途的气体,在工业上大量用于制造盐酸、有机溶剂和杀菌消毒剂等。甲同学在实验室进行氯气性质的研究
(1)甲同学依次进行了![]() 与①钠、②铜、③氢气、④水反应的实验。
与①钠、②铜、③氢气、④水反应的实验。
上述反应中属于氧化还原反应的是___________(填序号)。
(2)写出铁丝在氯气中燃烧的化学方程式:________。
(3)氯气溶于水得到的溶液称为氯水,新制的氯水呈_________色,新制的氯水中含有的物质为(水除外)________(填化学式)。
(4)甲同学探究氯气能否与水发生反应
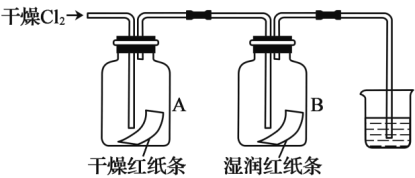
①B中纸条褪色,结合化学方程式解释原因:________。
②装置A的作用是___________。
③烧杯中发生反应的化学方程式为_________。
【答案】①②③④ 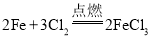 黄绿
黄绿 ![]() Cl2 + H2O HCl + HClO,生成的次氯酸有漂白性 对照实验,证明氯气自身没有漂白性,说明B中起漂白作用的是其他物质,从而证明氯气与水发生了反应
Cl2 + H2O HCl + HClO,生成的次氯酸有漂白性 对照实验,证明氯气自身没有漂白性,说明B中起漂白作用的是其他物质,从而证明氯气与水发生了反应 ![]()
【解析】
(1)氯气具有强氧化性,可与金属、非金属单质发生化合反应,与水反应生成HClO和HCl;
(2)铁在氯气中燃烧生成氯化铁;
(3)氯气溶于水后和水反应生成盐酸和次氯酸,该反应为可逆反应:Cl2 + H2O HCl+ HClO;
(4)①氯气和水发生反应生成的HClO具有漂白性;
②氯气不具有漂白性,干燥红纸不褪色,可作对照实验;
③烧杯中应盛放氢氧化钠溶液,用于吸收氯气,避免污染环境。
(1)氯气具有强氧化性,可与金属、非金属单质发生化合反应,与水反应生成HClO和HCl,则①②③④都为氧化还原反应,故答案为:①②③④;
(2)铁在氯气中燃烧生成氯化铁,反应的化学方程式为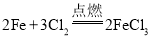 ,故答案为:
,故答案为: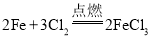 ;
;
(3)氯气溶于水后和水反应生成盐酸和次氯酸,该反应为可逆反应:Cl2 + H2O HCl+ HClO,则新制的氯水中含有的物质为(水除外)![]() ,新制氯水中由于含有氯气,所以溶液呈黄绿色,故答案为:黄绿;
,新制氯水中由于含有氯气,所以溶液呈黄绿色,故答案为:黄绿;![]() ;
;
(4)①氯气和水发生反应Cl2 + H2O HCl+ HClO,生成HClO,由于HClO具有漂白性,可使红纸条褪色,故答案为:Cl2 + H2O HCl+ HClO,生成的次氯酸有漂白性;
②氯气不具有漂白性,干燥红纸不褪色,作对照实验,证明氯气自身没有漂白性,说明B中起漂白作用的是其他物质,从而证明氯气与水发生了反应,故答案为:对照实验,证明氯气自身没有漂白性,说明B中起漂白作用的是其他物质,从而证明氯气与水发生了反应;
③烧杯中应盛放氢氧化钠溶液,用于吸收氯气,避免污染环境,发生反应的化学方程式为![]() ,故答案为:
,故答案为:![]() 。
。